Teori – Teori dan Struktur Atom
Konsep atom sudah dikenal sejak peradaban Yunani (500 SM). “Atom” berasal dari bahasa Yunani, yaitu atomos, yang berarti tidak dapat dibagi. Menurut filosof Yunani, atom dianggap sebagai partikel sangat kecil yang tidak dapat diurai lagi. Sayangnya, tidak ditemukan data atau eksperimen yang dapat menjelaskan pemikiran tersebut.
Pada tahun 1803, John Dalton menjelaskan postulat mengenai teori atom berdasarkan pemikiran kuno tersebut. Postulat teori atom Dalton berbunyi :
- Atom adalah zat yang terdiri dari bagian terkecil yang tidak dapat diurai
- Semua atom pada unsur yang sama bersifat identik, tetapi atom – atom yang berasal dari unsur yang berbeda memiliki sifat yang berbeda pula
- Senyawa kimia terbentuk dari atom – atom dengan jumlah perbandingan tertentu
- Reaksi kimia terjadi karena adanya perubahan susunan atom dari satu kombinasi menjadi kombinasi yang lain. Sifat individu atom sendiri tidak mengalami perubahan.
Postulat Dalton ini bertahan selama hampir seratus tahun. Kunci keberhasilan teori ini adalah adanya konsep yang menjelaskan bahwa tiap unsur memiliki atom dengan karakteristik massa tertentu.
Menjelang akhir 1800, teori atom Dalton mulai diragukan karena adanya penemuan sinar X (1895), radioaktifitas (1896), elektron (1897), dan unsur radium (1898). Penemuan – penemuan tersebut menunjukkan bahwa atom merupakan struktur yang sangat rumit, yang tersusun dari partikel – partikel sub atom. Rutherford dkk menemukan bahwa zat – zat radioaktif dapat menghasilkan tiga macam radiasi, yaitu radiasi yang bersifat positif (disebut partikel a), negatif (b) dan netral (g). Dengan dibuktikan bahwa suatu unsur dapat menghasilkan tiga macam radiasi yang berbeda sifat, maka teori atom Dalton tidak dapat diikuti lagi.
Pada tahun 1911, Rutherford menggambarkan atom sebagai suatu partikel bulat dengan suatu pusat kecil yang disebut sebagai inti atom (nucleus). Karena inti atom menolak partikel a, maka inti atom bermuatan positif. Elektron dibayangkan berada di luar inti, membentuk permukaan luar dari atom. Penelitian modern kemudian menunjukkan bahwa atom terbagi atas tiga macam partikel, yaitu proton, neutron, dan elektron.
Tabel 4.1 Partikel – partikel atom
| Massa | Muatan | |||
| gram | s m a | Coulomb | unit muatan elektronik | |
| Proton | 1,67 x 10-24 | 1,007276 | + 1,602 x 10-19 | +1 |
| Neutron | 1,67 x 10-24 | 1,008665 | 0 | 0 |
| Elektron | 9,11 x 10-28 | 0,000549 | – 1,602 x 10-19 | -1 |
Proton dan neutron membentuk inti. Karena proton bermuatan positif dan neutron tidak bermuatan, maka inti atom bermuatan positif. Banyaknya proton dalam inti disebut sebagai proton number (nomor proton) atau atomic number (nomor atom). Tiap unsur memiliki nomor atom yang berbeda – beda, contohnya karbon (C),memiliki nomor atom 6, nitrogen (N) memiliki nomor atom 7, oksigen (O) memiliki nomor atom 8, dll. Sampai dengan unsur bernomor atom 20, jumlah proton dan neutron dalam inti sama. Di atas nomor atom 20, jumlah neutron umumnya lebih besar dari pada jumlah proton. Misalnya, timbal (Pb) dengan jumlah proton 82, memiliki 125 neutron dalam inti. Banyaknya proton dan neutron dalam inti disebut nucleon number (nomor inti) atau mass number (nomor massa).
Elektron digambarkan mengelilingi inti atom menurut lintasan tertentu. Karena letaknya di luar, maka elektron – elektron inilah yang berperan ketika unsur – unsur mengalami reaksi atau membentuk ikatan. Susunan elektron di dalam atom menentukan sifat dari unsur yang bersangkutan.
4.2. Konfigurasi Elektron
Elektron tersusun dalam kulit – kulit (n) yang dapat dinyatakan dalam huruf kapital, yaitu K, L, M, N, O, … atau angka, yaitu 1, 2, 3, 4, 5, … . Tiap kulit memiliki sub – sub kulit yang dinyatakan dengan huruf, yaitu s, p d, f. Dalam sub – sub kulit terdapat ruang (orbital) yang dapat menampung elektron dengan kapasitas tertentu.
Tabel 4.2. Sub – sub kulit dan kapasitas elektron di dalamnya
|
Sub kulit |
Jumlah ruang (orbital) |
Kapasitas elektron |
|
S |
1 |
2 |
|
P |
3 |
6 |
|
D |
5 |
10 |
|
F |
7 |
14 |
Elektron diisikan pada ruang – ruang (orbital) dengan energi yang terendah lebih dulu. Sistem pengisian elektron berdasarkan tingkat energi ini disebut sebagai Azas Aufbau.
1. Teori Atom Democritus (460 SM–370 SM)
Democritus mengembangkan teori tentang penyusun suatu materi. Menurut Democritus jika suatu materi dibelah terus-menerus suatu ketika akan diperoleh suatu partikel fundamental yang disebut sebagai atom (Yunani: atomos = tidak terbagi). Pendapat ini ditolak oleh Aristoteles (384–322 SM), yang berpendapat bahwa materi bersifat kontinu (materi dapat dibelah terus-menerus sampai tidak berhingga). Aristoteles lebih menyetujui teori Empedokles, yaitu materi tersusun atas api, air tanah dan udara. Sekitar tahun 1592
model atom : demmocritus
2. Teori Atom John Dalton
Pada tahun 1803, John Dalton mengemukakan mengemukakan pendapatnaya tentang atom. Teori atom Dalton didasarkan pada dua hukum, yaitu hukum kekekalan massa (hukum Lavoisier) dan hukum susunan tetap (hukum prouts). Lavosier mennyatakan bahwa “Massa total zat-zat sebelum reaksi akan selalu sama dengan massa total zat-zat hasil reaksi”. Sedangkan Prouts menyatakan bahwa “Perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap”. Dari kedua hukum tersebut Dalton mengemukakan pendapatnya tentang atom sebagai berikut:
- Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi
- Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda
- Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana. Misalnya air terdiri atom-atom hidrogen dan atom-atom oksigen
Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau dimusnahkan.
Kelemahan teori atom Dalton
Pada perkembangan selanjutnya ditemukan berbagai fakta yang tidak dapat dijelaskan oleh teori tersebut, antara lain :
a. Tidak dapat menjelaskan sifat listrik materi.
b. Tidak dapat menjelaskan cara atom-atom saling berikatan.
c. Model atom Dalton tidak dapat menjelaskan perbedaan antara atom unsur yang satu dengan unsur yang lain.
 gambar : model atom dalton
gambar : model atom dalton
3. Teori Atom J. J. Thomson
Berdasarkan penemuan tabung katode yang lebih baik oleh William Crookers, maka J.J. Thomson meneliti lebih lanjut tentang sinar katode dan dapat dipastikan bahwa sinar katode merupakan partikel, sebab dapat memutar baling-baling yang diletakkan diantara katode dan anode. Dari hasil percobaan ini, Thomson menyatakan bahwa sinar katode merupakan partikel penyusun atom (partikel subatom) yang bermuatan negatif dan selanjutnya disebut elektron.
Atom merupakan partikel yang bersifat netral, oleh karena elektron bermuatan negatif, maka harus ada partikel lain yang bermuatan positifuntuk menetrallkan muatan negatif elektron tersebut. Dari penemuannya tersebut, Thomson memperbaiki kelemahan dari teori atom dalton dan mengemukakan teori atomnya yang dikenal sebagai Teori Atom Thomson. Yang menyatakan bahwa:
“Atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar muatan negatif elektron”
gambar: model atom JJ Thomson
4. Teori Atom Rutherford
Rutherford bersama dua orang muridnya (Hans Geigerdan Erners Masreden) melakukan percobaan yang dikenal dengan hamburan sinar alfa (λ) terhadap lempeng tipis emas. Sebelumya telah ditemukan adanya partikel alfa, yaitu partikel yang bermuatan positif dan bergerak lurus, berdaya tembus besar sehingga dapat menembus lembaran tipis kertas. Percobaan tersebut sebenarnya bertujuan untuk menguji pendapat Thomson, yakni apakah atom itu betul-betul merupakan bola pejal yang positif yang bila dikenai partikel alfa akan dipantulkan atau dibelokkan. Dari pengamatan mereka, didapatkan fakta bahwa apabila partikel alfa ditembakkan pada lempeng emas yang sangat tipis, maka sebagian besar partikel alfa diteruskan (ada penyimpangan sudut kurang dari 1°), tetapi dari pengamatan Marsden diperoleh fakta bahwa satu diantara 20.000 partikel alfa akan membelok sudut 90° bahkan lebih.
Berdasarkan gejala-gejala yang terjadi, diperoleh beberapa kesipulan beberapa berikut:
- Atom bukan merupakan bola pejal, karena hampir semua partikel alfa diteruskan
- Jika lempeng emas tersebut dianggap sebagai satu lapisanatom-atom emas, maka didalam atom emas terdapat partikel yang sangat kecil yang bermuatan positif.
Partikel tersebut merupakan partikelyang menyusun suatu inti atom, berdasarkan fakta bahwa 1 dari 20.000 partikel alfa akan dibelokkan. Bila perbandingan 1:20.000 merupakan perbandingan diameter, maka didapatkan ukuran inti atom kira-kira 10.000 lebih kecil daripada ukuran atom keseluruhan.
gambar : model atom Rutherford
5. Teori Atom Bohr
ada tahun 1913, pakar fisika Denmark bernama Neils Bohr memperbaiki kegagalan atom Rutherford melalui percobaannya tentang spektrum atom hidrogen. Percobaannya ini berhasil memberikan gambaran keadaan elektron dalam menempati daerah disekitar inti atom. Penjelasan Bohr tentang atom hidrogen melibatkan gabungan antara teori klasik dari Rutherford dan teori kuantum dari Planck, diungkapkan dengan empat postulat, sebagai berikut:
- Hanya ada seperangkat orbit tertentu yang diperbolehkan bagi satu elektron dalam atom hidrogen. Orbit ini dikenal sebagai keadaan gerak stasioner (menetap) elektron dan merupakan lintasan melingkar disekeliling inti.
- Selama elektron berada dalam lintasan stasioner, energi elektron tetap sehingga tidak ada energi dalam bentuk radiasi yang dipancarkan maupun diserap.
- Elektron hanya dapat berpindah dari satu lintasan stasioner ke lintasan stasioner lain. Pada peralihan ini, sejumlah energi tertentu terlibat, besarnya sesuai dengan persamaan planck, ΔE = hv.
- Lintasan stasioner yang dibolehkan memilki besaran dengan sifat-sifat tertentu, terutama sifat yang disebut momentum sudut. Besarnya momentum sudut merupakan kelipatan dari h/2∏ atau nh/2∏, dengan n adalah bilangan bulat dan h tetapan planck.
Menurut model atom bohr, elektron-elektron mengelilingi inti pada lintasan-lintasan tertentu yang disebut kulit elektron atau tingkat energi. Tingkat energi paling rendah adalah kulit elektron yang terletak paling dalam, semakin keluar semakin besar nomor kulitnya dan semakin tinggi tingkat energinya.
gambar: teori atom Neils Bohr
6. Teori Atom Modern
Model atom mekanika kuantum dikembangkan oleh Erwin Schrodinger (1926).Sebelum Erwin Schrodinger, seorang ahli dari Jerman Werner Heisenberg mengembangkan teori mekanika kuantum yang dikenal dengan prinsip ketidakpastian yaitu “Tidak mungkin dapat ditentukan kedudukan dan momentum suatu benda secara seksama pada saat bersamaan, yang dapat ditentukan adalah kebolehjadian menemukan elektron pada jarak tertentu dari inti atom”.
Daerah ruang di sekitar inti dengan kebolehjadian untuk mendapatkan elektron disebut orbital. Bentuk dan tingkat energi orbital dirumuskan oleh Erwin Schrodinger.Erwin Schrodinger memecahkan suatu persamaan untuk mendapatkan fungsi gelombang untuk menggambarkan batas kemungkinan ditemukannya elektron dalam tiga dimensi.
gambar: teori atom modern
UNSUR-UNSUR GOLONGAN UTAMA
Gas Mulia (Noble Gas)
Gas Mulia (Noble Gas) adalah bagian kecil dari atmosfer. Gas Mulia terletak pada Golongan VIIIA dalam sistem periodik. Gas mulia terdiri dari unsur Helium (He), Neon (Ne), Argon (Ar), Kripton (Kr), Xenon (Xe), dan Radon (Rn). Keistimewaan unsur-unsur gas mulia adalah memiliki konfigurasi elektron yang sempurna (lengkap), dimana setiap kulit dan subkulit terisi penuh elektron. Dengan demikian, elektron valensi unsur gas mulia adalah delapan (kecuali unsur Helium dengan dua elektron valensi). Konfigurasi demikian menyebabkan gas mulia cenderung stabil dalam bentuk monoatomik dan sulit bereaksi dengan unsur lainnya.
Keberadaan unsur-unsur Gas Mulia pertama kali ditemukan oleh Sir William Ramsey. Beliau adalah ilmuwan pertama yang berhasil mengisolasi gas Neon, Argon, Kripton, dan Xenon dari atmosfer. Beliau juga menemukan suatu gas yang diisolasi dari peluruhan mineral Uranium, yang mempunyai spektrum sama seperti unsur di matahari, yang disebut Helium. Helium terdapat dalam mineral radioaktif dan tercatat sebagai salah satu gas alam di Amerika Serikat. Gas Helium diperoleh dari peluruhan isotop Uranium dan Thorium yang memancarkan partikel α. Gas Radon, yang semua isotopnya radioaktif dengan waktu paruh pendek, juga diperoleh dari rangkaian peluruhan Uranium dan Thorium.
Saat mempelajari reaksi kimia dengan menggunakan gas PtF6 yang sangat reaktif, N. Bartlett menemukan bahwa dengan oksigen, akan terbentuk suatu padatan kristal [O2]+[PtF6]–. Beliau mencatat bahwa entalpi pengionan Xenon sama dengan O2. Dengan demikian, suatu reaksi yang analog diharapkan dapat terjadi. Ternyata, hal tersebut benar. Pada tahun 1962, beliau melaporkan senyawa pertama yang berhasil disintesis menggunakan Gas Mulia, yaitu padatan kristal merah dengan formula kimia [Xe]+[PtF6]–. Selanjutnya, berbagai senyawa Gas Mulia juga berhasil disintesis, diantaranya XeF2, XeF4, XeF6, XeO4, dan XeOF4.
Seluruh unsur Gas Mulia merupakan gas monoatomik. Dalam satu golongan, dari He sampai Rn, jari-jari atom meningkat. Dengan demikian,ukuran atom Gas Mulia meningkat, menyebabkan gaya tarik-menarik antar atom (Gaya London) semakin besar. Hal ini mengakibatkan kenaikan titik didih unsur dalam satu golongan. Sementara energi ionisasi dalam satu golongan menurun dari He sampai Rn. Hal ini menyebabkan unsur He, Ne, dan Ar tidak dapat membentuk senyawa (energi ionisasinya sangat tinggi), sementara unsur Kr dan Xe dapat membentuk senyawa (energi ionisasinya relatif rendah dibandingkan Gas Mulia lainnya). Gas Argon merupakan Gas Mulia yang paling melimpah di atmosfer (sekitar 0,934% volume udara), sedangkan Gas Helium paling melimpah di jagat raya (terlibat dalam reaksi termonuklir pada permukaan matahari). (klik di sini untuk melihat sifat Gas Mulia dalam Tabel Periodik)
Gas Neon, Argon, Kripton, dan Xenon diperoleh dengan fraksionasi udara cair. Gas-gas tersebut pada dasarnya bersifat inert (stabil/lembam), sebab kereaktifan kimianya yang rendah, sebagai konsekuensi dari konfigurasi elektron yang lengkap. Kegunaan utama gas Helium adalah sebagai cairan dalam krioskopi. Gas Argon digunakan untuk menyediakan lingkungan yang inert dalam peralatan laboratorium, dalam pengelasan, dan dalam lampu listrik yang diisi gas. Sementara gas Neon digunakan untuk tabung sinar pemutusan muatan.
Halogen (Halogen)
Unsur Halogen (Golongan VIIA) adalah unsur-unsur nonlogam yang reaktif. Halogen terdiri dari unsur Fluor (F), Klor (Cl), Brom (Br), Iod (I), dan Astatin (At). Astatin adalah unsur radioaktif dengan waktu hidup (life time) yang sangat singkat dan mudah meluruh menjadi unsur lain. Dalam pembahasan ini, kita hanya akan membicarakan empat unsur pertama Halogen. Secara umum, unsur Halogen bersifat toksik dan sangat reaktif. Toksisitas dan reaktivitas Halogen menurun dari Fluor sampai Iod. (klik di sini untuk melihat sifat Halogen dalam Tabel Periodik)
Dalam satu golongan, dari Fluor sampai Iod, jari-jari atom meningkat. Akibatnya, interaksi antar atom semakin kuat, sehingga titik didih dan titik leleh pun meningkat. Dalam keadaan standar (tekanan 1 atm dan temperatur 25°C), Fluor adalah gas berwarna kekuningan, Klor adalah gas berwarna hijau pucat, Brom adalah cairan berwarna merah kecoklatan, dan Iod adalah padatan berwarna ungu-hitam. Energi ionisasi menurun dalam satu golongan , demikian halnya keelektronegatifan dan potensial standar reduksi (E°red). Ini berarti, Flour paling mudah tereduksi (oksidator kuat), sedangkan Iod paling sulit tereduksi (oksidator lemah).
Beberapa keistimewaan unsur Fluor yang tidak dimiliki unsur Halogen lainnya adalah sebagai berikut :
1. Fluor adalah unsur yang paling reaktif dalam Golongan Halogen. Hal ini terjadi akibat energi ikatan F-F yang relatif rendah (150,6 kJ/mol) dibandingkan energi ikatan Cl-Cl (242,7 kJ/mol) maupun Br-Br (192,5 kJ/mol). Sebagai tambahan, ukuran atom F yang kecil menyebabkan munculnya tolakan yang cukup kuat antar lone pair F-F, sehingga ikatan F-F tidak stabil dan mudah putus. Hal ini tidak terjadi pada ikatan Cl-Cl maupun Br-Br sehingga keduanya relatif stabil dibandingkan ikatan F-F.
2. Senyawa Hidrogen Fluorida (HF) memiliki titik didih tertinggi akibat adanya ikatan Hidrogen. Sementara senyawa halida lainnya (HCl, HBr, dan HI) memiliki titik didih yang relatif rendah.
3. Hidrogen Fluorida (HF) adalah asam lemah, sedangkan asam halida lainnya (HCl, HBr, dan HI) adalah asam kuat.
4. Gas Fluor dapat bereaksi dengan larutan natrium hidroksida (NaOH) membentuk oksigen difluorida yang dapat dinyatakan dalam persamaan reaksi berikut :
2 F2(g) + 2 NaOH(aq) ——> 2 NaF(aq) + H2O(l) + OF2(g)
Sementara itu, reaksi yang analog juga terjadi pada Klor dan Brom, dengan produk yang berbeda. Reaksi yang terjadi adalah sebagai berikut :
Cl2(g) + 2 NaOH(aq) ——> NaCl(aq) + NaOCl(aq) + H2O(l)
Br2(l) + 2 NaOH(aq) ——> NaBr(aq) + NaOBr(aq) + H2O(l)
Kedua reaksi di atas dikenal dengan istilah Reaksi Disproporsionasi (Autoredoks). Iod tidak dapat bereaksi dalam kondisi ini
5. Senyawa Perak Fluorida (AgF) mudah larut dalam air, sedangkan perak halida lainnya (AgCl, AgBr, dan AgI) sukar larut dalam air.
Unsur Halogen membentuk berbagai variasi senyawa. Dalam keadaan standar, unsur bebas Halogen membentuk molekul diatomik (F2, Cl2, Br2, I2). Oleh karena kereaktifannya yang besar, Halogen jarang ditemukan dalam keadaan bebas. Halogen umumnya ditemukan dalam bentuk senyawa. Halogen yang ditemukan dalam air laut berbentuk halida (Cl–, Br–, dan I–). Sementara di kerak bumi, halogen berikatan dalam mineral, seperti Fluorite (CaF2) dan kriolit (Na3AlF6).
Antar Halogen dapat mengalami reaksi kimia. Oleh karena kekuatan oksidator menurun dari Fluor sampai Iod, Halogen dapat mengoksidasi Ion Halida yang terletak di bawahnya (displacement reaction). Dengan demikian, reaksi yang terjadi antar Halogen dapat disimpulkan dalam beberapa pernyataan di bawah ini :
1. F2 dapat mengoksidasi Cl– menjadi Cl2, Br– menjadi Br2, serta I– menjadi I2.
2. Cl2 dapat mengoksidasi Br– menjadi Br2, serta I– menjadi I2. Cl2 tidak dapat mengoksidasi F– menjadi F2.
3. Br2 dapat mengoksidasi I– menjadi I2. Br2 tidak dapat mengoksidasi F– menjadi F2 maupun Cl– menjadi Cl2.
4. I2 tidak dapat mengokisdasi F– menjadi F2, Cl– menjadi Cl2, serta Br– menjadi Br2.
Gas F2 dapat diperoleh dari elektrolisis cairan (bukan larutan) Hidrogen Fluorida yang diberi sejumlah padatan Kalium Fluorida untuk meningkatkan konduktivitas pada temperatur di atas 70°C. Di katoda, ion H+ akan tereduksi menjadi gas H2, sedangkan di anoda, ion F‑ akan teroksidasi menjadi gas F2.
Gas Cl2 dapat di peroleh melalui elektrolisis lelehan NaCl maupun elektrolisis larutan NaCl. Melalui kedua elektrolisis tersebut, ion Cl– akan teroksidasi membentuk gas Cl2 di anoda. Gas Cl2 juga dapat diperoleh melalui proses klor-alkali, yaitu elektrolisis larutan NaCl pekat (brine). Reaksi yang terjadi pada elektrolisis brine adalah sebagai berikut :
2 NaCl(aq) + 2 H2O(l) ——> 2 NaOH(aq) + H2(g) + Cl2(g)
Di laboratorium, unsur Klor, Brom, dan Iod dapat diperoleh melalui reaksi alkali halida (NaCl, NaBr, NaI) dengan asam sulfat pekat yang dipercepat dengan penambahan MnO2 sebagai katalis. Reaksi yang terjadi adalah sebagai berikut :
MnO2(s) + 2 H2SO4(aq) + 2 NaCl(aq) ——> MnSO4(aq) + Na2SO4(aq) + 2 H2O(l) + Cl2(g)
MnO2(s) + 2 H2SO4(aq) + 2 NaBr(aq) ——> MnSO4(aq) + Na2SO4(aq) + 2 H2O(l) + Br2(l)
MnO2(s) + 2 H2SO4(aq) + 2 NaI(aq) ——> MnSO4(aq) + Na2SO4(aq) + 2 H2O(l) + I2(s)
Halida dibedakan menjadi dua kategori, yaitu halida ionik dan halida kovalen. Fluorida dan klorida dari unsur logam, terutama unsur Alkali dan Alkali Tanah (kecuali Berilium) merupakan halida ionik. Sementara, flurida dan klorida dari unsur nonlogam, seperti Belerang dan Fosfat merupakan halida kovalen. Bilangan oksidasi Halogen bervariasi dari -1 hingga +7 (kecuali Fluor). Unsur Fluor yang merupakan unsur dengan keelektronegatifan terbesar di alam, hanya memiliki bilangan oksidasi 0 (F2) dan -1 (fluorida).
Halogen dapat bereaksi dengan Hidrogen menghasilkan Hidrogen Halida. Reaksi yang terjadi adalah sebagai berikut :
X2(g) + H2(g) ——> 2 HX(g)
X = F, Cl, Br, atau I
Reaksi ini (khususnya pada F2 dan Cl2)menimbulkan ledakan hebat (sangat eksotermis). Oleh karena itu, reaksi tersebut jarang digunakan di industri. Sebagai pengganti, hidrogen halida dapat dihasilkan melalui reaksi klorinasi hidrokarbon. Sebagai contoh :
C2H6(g) + Cl2(g) ——> C2H5Cl(g) + HCl(g)
Di laboratorium, hidrogen halida dapat diperoleh melalui reaksi antara logam halida dengan asam sulfat pekat. Reaksi yang terjadi adalah sebagai berikut :
CaF2(s) + H2SO4{aq) ——> 2 HF(g) + CaSO4(s)
2 NaCl(s) + H2SO4(aq) ——-> 2 HCl(g) + Na2SO4(aq)
Hidrogen Bromida dan Hidrogen Iodida tidak dapat dihasilkan melalui cara ini, sebab akan terjadi reaksi oksidasi (H2SO4 adalah oksidator kuat) yang menghasilkan Brom dan Iod. Reaksi yang terjadi adalah sebagai berikut :
2 NaBr(s) + 2 H2SO4(aq) ——> Br2(l) + SO2(g) + Na2SO4(aq) + 2 H2O(l)
Hidrogen Bromida dapat dibuat melalui beberapa reaksi berikut :
P4(s) + 6 Br2(l) ——> 4 PBr3(l)
PBr3(l) + 3 H2O(l) ——> 3 HBr(g) + H3PO3(aq)
Hidrogen Iodida dapat diperoleh dengan cara serupa.
Hidrogen Fluorida memiliki kereaktifan yang tinggi. Senyawa ini dapat bereaksi dengan silika melalui persamaan reaksi berikut :
6 HF(aq) + SiO2(s) ——> H2SiF6(aq) + 2 H2O(l)
Hidrogen Fluorida juga digunakan dalam proses pembuatan gas Freon. Reaksi yang terjadi adalah sebagai berikut :
CCl4(l) + HF(g) ——> CCl3F(g) + HCl(g)
CCl3F(g) + HF(g) ——> CCl2F2(g) + HCl(g)
Larutan Hidrogen Halida bersifat asam. Urutan kekuatan asam halida adalah HF << HCl < HBr < HI. Sedangkan urutan kekuatan asam oksi adalah HXO < HXO2 < HXO3 < HXO4 (X = Cl, Br, atau I).
Fluor (khususnya NaF) ditambahkan ke dalam air minum untuk mencegah terbentuknya karies (kerak atau plak) gigi. Senyawa lain, Uranium Fluorida, UF6, digunakan untuk memisahkan isotop radioaktif Uranium (U-235 dan U-238). Di bidang industri, Fluor digunakan untuk menghasilkan poli tetra fluoro etilena (Teflon).
Klor (khusunya Klorida, Cl–) memegang peranan penting dalam sistem kesetimbangan cairan interseluler dan ekstraseluler dalam organisme. Di bidang industri, Klor digunakan sebagai bahan pemutih (bleaching agent) pada industri kertas dan tekstil. Bahan pembersih rumah tangga umumnya mengandung sejumlah Klor (khususnya NaClO) yang berperan sebagai bahan aktif pengangkat kotoran. Sementara, senyawa klor lainnya, HClO, berfungsi sebagai agen desinfektan pada proses pemurnian air. Reaksi yang terjadi saat gas Klor dilarutkan dalam air adalah sebagai berikut :
Cl2(g) + H2O(l) ——> HCl(aq) + HClO(aq)
Ion OCl– yang dihasilkan dari reaksi tersebut berperan sebagai agen desinfektan yang membunuh kuman dalam air.
Metana yang terklorinasi, seperti Karbon Tetraklorida (CCl4) dan Kloroform (CHCl3) digunakan sebagai pelarut senyawa organik. Klor juga digunakan dalam pembuatan insektisida, seperti DDT. Akan tetapi, penggunaan DDT dapat mencemari lingkungan, sehingga kini penggunaannya dilarang atau dibatasi sesuai dengan Undang-Undang Lingkungan. Klor juga digunakan sebagai bahan baku pembuatan poli vinil klorida (PVC).
Senyawa Bromida ditemukan di air laut (ion Br–). Brom digunakan sebagai bahan dasar pembuatan senyawa Etilena Dibromida (BrCH2CH2Br), suatu insektisida. Senyawa ini sangat karsinogenik. Di samping itu, Brom juga dapat bereaksi dengan Perak menghasilkan senyawa Perak Bromide (AgBr) yang digunakan dalam lembaran film fotografi.
Iod jarang digunakan dalam kehidupan sehari-hari. Larutan Iod dalam alkohol (50% massa) sering digunakan di dunia medis sebagai zat antiseptik. Iod juga merupakan salah satu komponen dari hormon tiroid. Defisiensi Iod dapat mengakibatkan pembengkakan kelenjar gondok.
Alkali (Alkali)
Logam Alkali (Golongan IA) adalah unsur yang sangat elektropositif (kurang elektronegatif). Umumnya, logam Alkali berupa padatan dalam suhu ruang. Unsur Alkali terdiri dari Litium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Sesium (Cs), dan Fransium (Fr). Fransium jarang dipelajari sebagai salah satu anggota unsur Golongan IA, sebab Fransium adalah unsur radioaktif yang tidak stabil dan cenderung meluruh membentuk unsur baru lainnya. Dari konfigurasi elektron unsur, masing-masing memiliki satu elektron valensi . Dengan demikian, unsur Alkali cenderung membentuk ion positif bermuatan satu (M+). (klik di sini untuk melihat sifat Alkali dalam Tabel Periodik)
Dalam satu golongan, dari Litium sampai Sesium, jari-jari unsur akan meningkat. Letak elektron valensi terhadap inti atom semakin jauh. Oleh sebab itu, kekuatan tarik-menarik antara inti atom dengan elektron valensi semakin lemah. Dengan demikian, energi ionisasi akan menurun dari Litium sampai Sesium. Hal yang serupa juga ditemukan pada sifat keelektronegatifan unsur .
Secara umum, unsur Alkali memiliki titik leleh yang cukup rendah dan lunak, sehingga logam Alkali dapat diiris dengan pisau. Unsur Alkali sangat reaktif, sebab mudah melepaskan elektron (teroksidasi) agar mencapai kestabilan (konfigurasi elektron ion Alkali menyerupai konfigurasi elektron Gas Mulia). Dengan demikian, unsur Alkali jarang ditemukan bebas di alam. Unsur Alkali sering dijumpai dalam bentuk senyawanya. Unsur Alkali umumnya bereaksi dengan unsur lain membentuk senyawa halida, sulfat, karbonat, dan silikat.
Natrium dan Kalium terdapat dalam jumlah yang melimpah di alam. Keduanya terdapat dalam mineral seperti albite (NaAlSi3O8) dan ortoklas (KAlSi3O8). Selain itu, mineral lain yang mengandung Natrium dan Kalium adalah halite (NaCl), Chile saltpeter (NaNO3), dan silvit (KCl).
Logam Natrium dapat diperoleh dari elektrolisis lelehan NaCl (proses Down). Titik leleh senyawa NaCl cukup tinggi (801°C), sehingga diperlukan jumlah energi yang besar untuk melelehkan padatan NaCl. Dengan menambahkan zat aditif CaCl2, titik leleh dapat diturunkan menjadi sekitar 600°C, sehingga proses elektrolisis dapat berlangsung lebih efektif tanpa pemborosan energi.
Sebaliknya, logam Kalium tidak dapat diperoleh melalui metode elektrolisis lelehan KCl. Logam Kalium hanya dapat diperoleh melalui reaksi antara lelehan KCl dengan uap logan Natrium pada suhu 892°C. Reaksi yang terjadi adalah sebagai berikut :
Na(g) + KCl(l) <——> NaCl(l) + K(g)
Natrium dan Kalium adalah unsur logam yang sangat reaktif. Logam Kalium lebih reaktif dibandingkan logam Natrium. Kedua logam tersebut dapat berekasi dengan air membentuk hidroksida. Saat direaksikan dengan oksigen dalam jumlah terbatas, Natrium dapat membentuk oksidanya (Na2O). Namun, dalam jumlah oksigen berlebih, Natrium dapat membentuk senyawa peroksida (Na2O2).
2 Na(s) + O2(g) ——> Na2O2(s)
Natrium peroksida bereaksi dengan air menghasilkan larutan hidroksida dan hidrogen peroksida. Reaksi yang terjadi adalah sebagai berikut :
Na2O2(s) + 2 H2O(l) ——> 2 NaOH(aq) + H2O2(aq)
Sama seperti Natrium, logam Kalium dapat membentuk peroksida saat bereaksi dengan oksigen berlebih. Selain itu, logam Kalium juga membentuk superoksida saat dibakar di udara. Reaksi yang terjadi adalah sebagai berikut :
K(s) + O2(g) ——> KO2(s)
Saat Kalium Superoksida dilarutkan dalam air, akan dibentuk gas oksigen. Reaksi yang terjadi adalah sebagai berikut :
2 KO2(s) + 2 H2O(l) ——> 2 KOH(aq) + O2(g) + H2O2(aq)
Unsur Natrium dan Kalium berperan penting dalam mengatur keseimbangan cairan dalam tubuh. Ion Natrium dan ion Kalium terdapat dalam cairan intraseluler dan ekstraseluler. Keduanya berperan penting dalam menjaga tekanan osmosis cairan tubuh serta mempertahankan fungsi enzim dalam mengkatalisis reaksi biokimia dalam tubuh.
Natrium Karbonat (soda abu) digunakan dalam industri pengolahan air dan industri pembuatan sabun, detergen, obat-obatan, dan zat aditif makanan. Selain itu, Natrium Karbonat digunakan juga pada industri gelas. Senyawa ini dibentuk melalui proses Solvay. Reaksi yang terjadi pada proses Solvay adalah sebagai berikut :
NH3(aq) + NaCl(aq) + H2CO3(aq) ——> NaHCO3(s) + NH4Cl(aq)
2 NaHCO3(s) ——> Na2CO3(s) + CO2(g) + H2O(g)
Sumber mineral lain yang mengandung senyawa Natrium Karbonat adalah trona, dengan formula kimia [Na5(CO3)2(HCO3).2H2O]. Mineral ini ditemukan dalam jumlah besar di Wyoming, Amerika Serikat. Ketika mineral trona dipanaskan, akan terjadi reaksi penguraian sebagai berikut :
2 Na5(CO3)2(HCO3).2H2O(s) ——> 5 Na2CO3(s) + CO2(g) + 3 H2O(g)
Natrium Hidroksida dan Kalium Hidroksida masing-masing diperoleh melalui elektrolisis larutan NaCl dan KCl. Kedua hidroksida ini merupakan basa kuat dan mudah larut dalam air. Larutan NaOH digunakan dalam pembuatan sabun . Sementara itu, larutan KOH digunakan sebagai larutan elektrolit pada beberapa baterai (terutama baterai merkuri).
Chile saltpeter (Natrium Nitrat) terurai membentuk gas oksigen pada suhu 500°C. Reaksi penguraian yang terjadi adalah sebagai berikut :
2 NaNO3(s) ——> 2 NaNO2(s) + O2(g)
Kalium Nitrat (saltpeter) dapat dibuat melalui reaksi berikut :
KCl(aq) + NaNO3(aq) ——> KNO3(aq) + NaCl(aq)
Alkali Tanah (Alkaline Earth)
Unsur Alkali Tanah mempunyai sifat yang menyerupai unsur Alkali. Unsur Alkali Tanah umumnya merupakan logam, cenderung membentuk ion positif, dan bersifat konduktif, baik termal maupun elektrik. Unsur Alkali Tanah kurang elektropositif (lebih elektronegatif) dan kurang reaktif bila dibandingkan unsur Alkali. Semua unsur Golongan IIA ini memiliki sifat kimia yang serupa, kecuali Berilium (Be). Yang termasuk unsur Golongan IIA adalah Berilium (Be), Magnesium (Mg), Kalsium (Ca), Stronsium (Sr), Barium (Ba), dan Radium (Ra). Radium jarang dipelajari sebagai salah satu anggota unsur Golongan IIA, sebab Radium adalah unsur radioaktif yang tidak stabil dan cenderung meluruh membentuk unsur baru lainnya. Konfigurasi elektron menunjukkan unsur-unsur Golongan IIA memiliki dua elektron valensi. Dengan demikian, untuk mencapai kestabilan, unsur Golongan IIA melepaskan dua elektron membentuk ion bermuatan positif dua (M2+). (klik di sini untuk melihat sifat Alkali Tanah dalam Tabel Periodik)
Dalam satu golongan, dari Berilium sampai Barium, jari-jari unsur meningkat. Peningkatan ukuran atom diikuti dengan peningkatan densitas unsur. Sebaliknya, energi ionisasi dan keelektronegatifan berkurang dari Berilium sampai Radium. Semakin besar jari-jari unsur, semakin mudah unsur melepaskan elektron valensinya. Potensial standar reduksi (E°red) menurun dalam satu golongan. Hal ini menunjukkan bahwa kekuatan reduktor meningkat dalam satu golongan dari Berilium sampai Barium.
Magnesium adalah unsur yang cukup melimpah di kerak bumi (urutan keenam, sekitar 2,5% massa kerak bumi). Beberapa bijih mineral yang mengandung logam Magnesium, antara lain brucite, Mg(OH)2, dolomite (CaCO3.MgCO3), dan epsomite (MgSO4.7H2O). Air laut merupakan sumber Magnesium yang melimpah (1,3 gram Magnesium per kilogram air laut). Magnesium diperoleh melalui elektrolisis lelehan MgCl2.
Magnesium tidak bereaksi dengan air dingin. Magnesium hanya bereaksi dengan air panas (uap air). Reaksi yang terjadi adalah sebagai berikut :
Mg(s) + H2O(g) ——> MgO(s) + H2(g)
Magnesium juga bereaksi dengan udara membentuk Magnesium Oksida dan Magnesium Nitrida. Reaksi yang terjadi adalah sebagai berikut :
2 Mg(s) + O2(g) ——> 2 MgO(s)
3 Mg(s) + N2(g) ——> Mg3N2(s)
Magnesium Oksida bereaksi lambat dengan air menghasilkan Magnesium Hidroksida (milk of magnesia), yang digunakan sebagai zat aktif untuk menetralkan asam lambung berlebih. Reaksi pembentukan milk of magnesia adalah sebagai berikut :
MgO(s) + H2O(l) ——> Mg(OH)2(s)
Hidroksida dari Magnesium merupakan basa kuat. Semua unsur Golongan IIA membentuk basa kuat, kecuali Be(OH)2 yang bersifat amfoter. Senyawa bikarbonat, MgHCO3 (maupun CaHCO3), menyebabkan kesadahan air sementara (dapat dihilangkan dengan cara pemanasan).
Logam Magnesium terutama digunakan dalam bidang konstruksi. Sifatnya yang ringan menjadikannya sebagai pilihan utama dalam pembentukan alloy (paduan logam). Logam Magnesium juga digunakan dalam proteksi katodik untuk mencegah logam besi dari korosi (perkaratan), reaksi kimia organik (reaksi Grignard), dan sebagai elektroda baterai . Sementara itu, dalam sistem kehidupan, ion Mg2+ ditemukan dalam klorofil (zat hijau daun) tumbuhan dan berbagai enzim pada organisme yang mengkatalisis reaksi biokimia penunjang kehidupan.
Kerak bumi mengandung 3,4 persen massa unsur Kalsium. Kalsium dapat ditemukan dalam berbagai senyawa di alam, seperti limestone, kalsit, dan batu gamping (CaCO3); dolomite (CaCO3.MgCO3); gypsum (CaSO4.2H2O); dan fluorite (CaF2). Logam Kalsium dapat diperoleh melalui elektrolisis lelehan CaCl2.
Kalsium (sama seperti Stronsium dan Barium) dapat bereaksi dengan air dingin membentuk hidroksida, Ca(OH)2. Senyawa Ca(OH)2 ini dikenal dengan istilah slaked lime atau hydrate lime. Reaksi tersebut jauh lebih lambat bila dibandingkan reaksi logam Alkali dengan air.
Ca(s) + 2 H2O(l) ——> Ca(OH)2(aq) + H2(g)
Kapur (lime), CaO, atau sering disebut dengan istilah quicklime, adalah salah satu material tertua yang dikenal manusia sejak zaman purba. Quicklime dapat diperoleh melalui penguraian termal senyawa Kalsium Karbonat. Reaksi yang terjadi adalah sebagai berikut :
CaCO3(s) ——> CaO(s) + CO2(g)
Slaked lime juga dapat dihasilkan melalui reaksi antara quicklime dengan air. Reaksi yang terjadi adalah sebagai berikut :
CaO(s) + H2O(l) ——> Ca(OH)2(aq)
Quicklime digunakan pada industri metalurgi sebagai zat aktif untuk menghilangkan SO2 pada bijih mineral. Sementara slaked lime digunakan dalam pengolahan air bersih. Logam Kalsium digunakan sebagai agen penarik air (dehydrating agent) pada pelarut organik. Unsur Kalsium merupakan komponen utama penyusun tulang dan gigi. Ion kalsium dalam tulang dan gigi terdapat dalam senyawa kompleks garam fosfat, yaitu hidroksiapatit (Ca5(PO4)3OH). Ion Kalsium juga berfungsi sebagai kofaktor berbagai enzim, faktor penting dalam proses pembekuan darah, kontraksi otot, dan transmisi sinyal sistem saraf pusat.
Untuk membedakan unsur-unsur Golongan IIA, dapat dilakukan pengujian kualitatif melalui tes nyala. Saat masing-masing unsur dibakar dengan pembakar Bunsen, akan dihasilkan warna nyala yang bervariasi. Magnesium menghasilkan nyala berwarna putih terang, Kalsium menghasilkan nyala berwarna merah bata, Stronsium menghasilkan nyala berwarna merah terang, sedangkan Barium menghasilkan nyala berwarna hijau.
Garam yang terbentuk dari unsur Golongan IIA merupakan senyawa kristalin ionik tidak berwarna. Garam tersebut dapat dibentuk melalui reaksi logam, oksida logam, atau senyawa karbonat dengan asam. Berikut ini adalah contoh beberapa reaksi pembentukan garam :
1. Mg(s) + 2 HCl(aq) ——> MgCl2(aq) + H2(g)
2. MgO(s) + 2 HCl(aq) ——> MgCl2(aq) + H2O(l)
3. MgCO3(s) + 2 HCl(aq) ——> MgCl2(aq) + H2O(l) + CO2(g)
Senyawa nitrat mengalami penguraian termal membentuk oksida logam, nitrogen dioksida, dan gas oksigen. Sebagai contoh :
2 Mg(NO3)2(s) ——> 2 MgO(s) + 4 NO2(g) + O2(g)
Senyawa karbonat mengalami penguraian termal membentuk oksida logam dan gas karbon dioksida. Sebagai contoh :
BaCO3(s) ——> BaO(s) + CO2(g)
Unsur-Unsur Periode Ketiga (Periode 3 Elements)
Unsur-unsur periode ketiga memiliki sifat kimia dan sifat fisika yang bervariasi. Unsur-unsur yang terdapat pada periode ketiga adalah Natrium (Na), Magnesium (Mg), Aluminium (Al), Silikon (Si), Fosfor (P), Belerang (S), Klor (Cl), dan Argon (Ar). Dari kiri (Natrium) sampai kanan (Argon), jari-jari unsur menyusut, sedangkan energi ionisasi, afinitas elektron, dan keelektronegatifan meningkat. Selain itu, terjadi perubahan sifat unsur dari logam (Na, Mg, Al) menjadi semilogam/metaloid (Si), nonlogam (P, S, Cl), dan gas mulia (Ar). Unsur logam umumnya membentuk struktur kristalin, sedangkan unsur semilogam/metaloid membentuk struktur molekul raksasa (makromolekul). Sementara, unsur nonlogam cenderung membentuk struktur molekul sederhana. Sebaliknya, unsur gas mulia cenderung dalam keadaan gas monoatomik. Variasi inilah yang menyebabkan unsur periode ketiga dapat membentuk berbagai senyawa dengan sifat yang berbeda. (klik di sini untuk melihat sifat Unsur Periode Ketiga dalam Tabel Periodik)
Unsur-unsur periode ketiga dapat membentuk oksida melalui reaksi pembakaran dengan gas oksigen. Reaksi yang terjadi pada masing-masing unsur adalah sebagai berikut :
1. Natrium Oksida
Natrium mengalami reaksi hebat dengan oksigen. Logam Natrium yang terpapar di udara dapat bereaksi spontan dengan gas oksigen membentuk oksida berwarna putih yang disertai nyala berwarna kuning.
4 Na(s) + O2(g) ——> 2 Na2O(s)
2. Magnesium Oksida
Magnesium juga bereaksi hebat dengan udara (terutama gas oksigen) menghasilkan nyala berwarna putih terang yang disertai dengan pembentukan oksida berwarna putih.
2 Mg(s) + O2(g) ——> 2 MgO(s)
3. Aluminium Oksida
Oksida ini berfungsi mencegah (melindungi) logam dari korosi. Oksida ini berwarna putih.
4 Al(s) + 3 O2(g) ——> 2 Al2O3(s)
4. Silikon Oksida (Silika)
Si(s) + O2(g) ——> SiO2(s)
5. Fosfor (V) Oksida
Fosfor mudah terbakar di udara. Ketika terdapat gas oksigen dalam jumlah berlebih, oksida P4O10 yang berwarna putih akan dihasilkan.
P4(s) + 5 O2(g) ——> P4O10(s)
6. Belerang Dioksida dan Belerang Trioksida
Padatan Belerang mudah terbakar di udara saat dipanaskan dan akan menghasilkan gas Belerang Dioksida (SO2). Oksida ini dapat direaksikan lebih lanjut dengan gas oksigen berlebih yang dikatalisis oleh Vanadium Pentaoksida (V2O5) untuk menghasilkan gas Belerang Trioksida (SO3).
S(s) + O2(g) ——>SO2(g)
2 SO2(g) + O2(g) ——> 2SO3(g)
7. Klor (VII) Oksida
2 Cl2(g) + 7 O2(g) ——> 2 Cl2O7(g)
Selain dapat membentuk oksida, unsur-unsur periode ketiga juga dapat membentuk senyawa halida. Senyawa tersebut terbentuk saat unsur direaksikan dengan gas klor. Reaksi yang terjadi pada masing-masing unsur adalah sebagai berikut :
1. Natrium Klorida
Natrium direaksikan dengan gas klor akan menghasilkan endapan putih NaCl.
2 Na(s) + Cl2(g) ——> 2 NaCl(s)
2. Magnesium Klorida
Sama seperti Natrium, logam Magnesium pun dapat bereaksi dengan gas klor membentuk endapan putih Magnesium Klorida.
Mg(s) + Cl2(g) ——> MgCl2(s)
3. Aluminium Klorida
Ketika logam Aluminium direaksikan dengan gas klor, akan terbentuk endapan putih AlCl3.
2 Al(s) + 3 Cl2(g) ——> 2 AlCl3(s)
Dalam bentuk uap, senyawa ini akan membentuk dimer Al2Cl6.
4. Silikon (IV) Klorida
Senyawa ini merupakan cairan yang mudah menguap. Senyawa ini dihasilkan dari reaksi padatan Silikon dengan gas klor.
Si(s) + 2 Cl2(g) ——> SiCl4(l)
5. Fosfor (III) Klorida dan Fosfor (V) Klorida
Fosfor (III) Klorida merupakan cairan mudah menguap tidak berwarna yang dihasilkan saat Fosfor bereaksi dengan gas klor tanpa pemanasan. Saat jumlah gas klor yang digunakan berlebih, senyawa ini dapat bereaksi kembali dengan gas klor berlebih membentuk senyawa Fosfor (V) Klorida, suatu padatan berwarna kuning.
P4(s) + 6 Cl2(g) ——> 4 PCl3(l)
Saat jumlah gas klor yang digunakan berlebih, akan terjadi reaksi berikut :
PCl3(l) + Cl2(g) ——> PCl5(s)
6. Belerang (II) Oksida
S(s) + Cl2(g) ——> SCl2(s)
Reaksi antara logam Natrium dan Magnesium dengan air adalah reaksi redoks. Dalam reaksi ini, unsur logam mengalami oksidasi dan dihasilkan gas hidrogen. Larutan yang dihasilkan bersifat alkali (basa). Logam Natrium lebih reaktif dibandingkan logam Magnesium, sehingga larutan NaOH bersifat lebih basa dibandingkan larutan Mg(OH)2.Padatan NaOH lebih mudah larut dalam air dibandingkan padatan Mg(OH)2.
Oksida dari logam Natrium dan Magnesium merupakan senyawa ionik dengan struktur kristalin. Saat dilarutkan dalam air, masing-masing oksida akan menghasilkan larutan basa. Oleh karena itu, dapat disimpulkan bahwa oksida logam dalam air menghasilkan larutan basa.
Na2O(s) + H2O(l) ——> 2 NaOH(aq)
MgO(s) + H2O(l) ——> Mg(OH)2(aq)
Aluminium Oksida memiliki struktur kristalin dan memiliki sifat kovalen yang cukup signifikan. Dengan demikian, senyawa ini dapat membentuk ikatan antarmolekul (intermediate bonding). Senyawa ini sukar larut dalam air.
Fosfor (V) Oksida merupakan senyawa kovalen. Senyawa ini dapat bereaksi dengan air membentuk asam fosfat. Asam fosfat merupakan salah satu contoh larutan asam lemah dengan pH berkisar antara 2 hingga 4. Reaksi yang terjadi adalah sebagai berikut :
P4O10(s) + 6 H2O(l) ——> 4 H3PO4(aq)
Belerang Dioksida dan Belerang Trioksida mempunyai struktur molekul kovalen sederhana. Masing-masing dapat bereaksi dengan air membentuk larutan asam.
SO2(g) + H2O(l) ——> H2SO3(aq)
SO3(g) + H2O(l) ——> H2SO4(aq)
Dengan demikian, senyawa oksida yang dihasilkan dari unsur periode ketiga dapat dikelompokkan menjadi tiga kategori, yaitu :
1. Oksida Logam (di sebelah kiri Tabel Periodik) memiliki struktur ionik kristalin dan bereaksi dengan air menghasilkan larutan basa. Oksida Logam merupakan oksida basa, yang dapat bereaksi dengan asam membentuk garam.
MgO(s) + H2SO4(aq) ——> MgSO4(aq) + H2O(l)
2. Oksida Nonlogam (di sebelah kanan Tabel Periodik) memiliki struktur molekul kovelen sederhana dan bereaksi dengan air menghasilkan larutan asam. Oksida nonlogam merupakan oksida asam, yang dapat bereaksi dengan basa membentuk garam.
SO3(g) + MgO(s) ——> MgSO4(s)
3. Oksida Amfoterik (di tengah Tabel Periodik) memiliki sifat asam dan basa sekaligus. Oksida tersebut dapat bereaksi dengan asam maupun basa.
Al2O3(s) + 6 HCl(aq) ——> 2 AlCl3(aq) + 3 H2O(l)
Al2O3(s) + 6 NaOH(aq) + 3 H2O(l) ——> 2 Na3Al(OH)6(aq)
Natrium Klorida dan Magnesium Klorida merupakan senyawa ionik dengan struktur kristalin yang teratur. Saat dilarutkan dalam air, kedua senyawa tersebut menghasilkan larutan netral (pH = 7). Sementara itu, Aluminium Klorida membentuk struktur dimernya, yaitu Al2Cl6 (untuk mencapai konfigurasi oktet). Senyawa dimer ini larut dalam air.
Al2Cl6(s) + 12 H2O(l) ——> 2 [Al(H2O)6]3+(aq) + 6 Cl–(aq)
Cairan Silikon (IV) Klorida dan gas PCl5 merupakan molekul kovalen sederhana. Masing-masing senyawa bereaksi hebat dengan air membentuk gas HCl. Reaksi ini dikenal dengan istilah hidrolisis. Larutan yang terbentuk bersifat asam. Reaksi yang terjadi adalah sebagai berikut :
SiCl4(l) + 2 H2O(l) ——> SiO2(s) + 4 HCl(g)
PCl5(s) + 4 H2O(l) ——> H3PO4(aq) + 5 HCl(g)
Dengan demikian, senyawa halida yang dibentuk dari unsur periode ketiga dapat dikelompokkan menjadi dua, yaitu :
1. Logam Klorida ( di sebelah kiri Tabel Periodik) memiliki struktur kristalin ionikdan mudah bereaksi dengan air membentuk larutan netral. Logam Klorida bersifat netral.
2. Nonlogam Klorida (di sebelah kanan Tabel Periodik) memiliki struktur molekul kovalen sederhana dan bereaksi dengan air menghasilkan larutan asam. Nonlogam Klorida bersifat asam.
Referensi:
Andy. 2009. Pre-College Chemistry.
Cotton, F. Albert dan Geoffrey Wilkinson. 1989. Kimia Anorganik Dasar. Jakarta: Penerbit UI Press
Chang, Raymond. 2007. Chemistry Ninth Edition. New York: Mc Graw Hill.
Ratcliff, Brian, dkk. 2006. AS Level and A Level Chemistry. Dubai: Oriental Press.
Moore, John T. 2003. Kimia For Dummies. Indonesia: Pakar Raya.
POLIMER
Kata polimer berasal dari bahasa Yunani, yaitu poly dan meros. Poly berarti banyak dan meros berarti unit atau bagian. Jadi polimer adalah makromolekul (molekul raksasa) yang tersusun dari monomer yang merupakan molekul yang kecil dan sederhana.
Monomer
Molekul-molekul kecil pembentuk polimer disebut monomer. Untuk contoh, etilena adalah monomer yang dapat dipolimerisasi menjadi polietilena. Asam amino termasuk monomer juga, yang dapat dipolimerisasi menjadi polipeptida dengan pelepasan air
- Penggolongan Polimer
- Berdasarkan Asalnya
1) Polimer alam
Polimer alam adalah polimer yang terbentuk secara alami di dalam tubuh makhluk hidup.
Tabel beberapa contoh polimer alam :
| No. | Polimer | Monomer | Polimerisasi | Terdapat pada |
| 1. | Amilum | Glukosa | Kondensasi | Biji-bijian,akar umbi |
| 2. | Selulosa | Glukosa | Kondensasi | Sayur, kayu, kapas |
| 3. | Protein | Asam amino | Kondensasi | Susu,daging,telur, wol, sutera |
| 4. | Asam nukleat | Nukleotida | Kondensasi | Molekul DNA, RNA |
| 5. | Karet alam | Isoprene | Adisi | Getah karet alam |
Sifat-sifat polimer alam kurang menguntungkan. Contohnya, karet alam kadang-kadang cepat rusak, tidak elastis, dan berombak. Hal tersebut dapat terjadi karena karet alam tidak tahan terhadap minyak bensin atau minyak tanah serta lama terbuka di udara. Contoh lain, sutera dan wol merupakan senyawa protein bahan makanan bakteri, sehingga wol dan sutera cepat rusak. Umumnya polimer alam mempunyai sifat hidrofilik (suka air), sukar dilebur dan sukar dicetak, sehingga sangat sukar mengembangkan fungsi polimer alam untuk tujuan-tujuan yang lebih luas dalam kehidupan masyarakat sehari-hari.
2) Polimer semi sintetis
Polimer semi adalah polimer yang diperoleh dari hasil modifikasi polimer alam dan bahan kimia.
Contoh : selulosa nitrat yang sering dipasarkan dengan nama celluloid dan guncotton.
3) Polimer sintetis
Polimer sintesis atau polimer buatan adalah polimer yang tidak terdapat di alam dan harus dibuat oleh manusia. Sampai saat ini, para ahli kimia polimer telah melakukan penelitian struktur molekul alam guna mengembangkan polimer sintesisnya. Dari hasil penelitian tersebut dihasilkan polimer sintesis yang dapat dirancang sifat-sifatnya, seperti tinggi rendahnya titik lebur, kelenturan dan kekerasannya, serta ketahanannya terhadap zat kimia. Tujuannya, agar diperoleh polimer sintesis yang penggunaannya sesuai yang diharapkan. Polimer sintesis yang telah dikembangkan guna kepentingan komersil, misalnya pembentukan serat untuk benang kain dan produksi ban yang elastis terhadap jalan raya. Ahli kimia saat ini sudah berhasil mengembangkan beratus-ratus jenis polimer sintesis untuk tujuan yang lebih luas. Contoh polimer sintesis dapat dilihat pada tabel di bawah ini :
|
No. |
Polimer |
Monomer |
Polimerisasi |
Terdapat pada |
|
1. |
Polietena | Etena | Adisi | Kantung, kabel plastik |
|
2. |
Polipropena | Propena | Adisi | Tali,karung,botol plastik |
|
3. |
PVC | Vinil klorida | Adisi | Pipa pralon,pelapis lantai, kabel listrik |
|
4. |
Polivinil alkohol | Vinil alkohol | Adisi | Bak air |
|
5. |
Teflon | Tetrafluoro etena | Adisi | Wajan, panci anti lengket |
|
6. |
Dakron | Metal tereftalat dan etilen glikol | Kondensasi | Pita rekam magnetik, kain,tekstil,wol sintetis |
|
7. |
Nilon | Asam adipat dan heksametilen diamin | Kondensasi | Tekstil |
|
8. |
Polibutadiena | Butadiena | Adisi | Ban motor, mobil |
- Penggolongan Polimer berdasarkan jenis monomer pembentuknya :
Polimer dapat digolongkan berdasarkan jenis monomer pembentuknya, sifatnya ada yang tahan terhadap panas dan asalnya. Berdasarkan jenis monomer pembentuknya, polimer dibedakan atas homopolimer dan kopolimer.
a) Homopolimer, terbentuk dari sejenis monomer, misalnya polietilena, PVC, teflon dan lain-lain.
Gambar 1 : Contoh Homopolimer
b) Kopolimer, terbentuk lebih dari sejenis monomer, misalnya nilon 66, dakron, karet SBR dan lain-lain. Pembentukan kopolimer dapat dikendalikan, agar terjadi pola sambungan yang berbeda (dari 2 monomer, misalnya A dan B).
- Berdasarkan sifatnya terhadap panas polimer dibedakan menjadi polimer termoplastik dan polimer thermosetting.
a) Polimer termoplastik
Polimer termoplastik adalah polimer yang jika dipanaskan melunak, sehingga dapat didaur ulang, seperti polietilena, polipropilen, PVC.
b) polimer termosetting
Polimer termosetting adalah jika dipanaskan menjadi keras dan kaku, sehingga tidak dapat didaur ulang, seperti bakelit (untuk peralatan listrik). Berdasarkan asalnya, ada polimer alam seperti amilum, protein, sellulosa, dan ada polimer sintetis, seperti plastik, nilon, PVC dan lain-lain.
Gambar 2 : Contoh polimer termosetting
- Kegunaan polimer dalam kehidupan sehari-hari adalah sebagai berikut :
a) Plastik Polietilentereftalat (PET)
Plastik PET merupakan serat sintetik poliester (dakron) yang transparan dengan daya tahan kuat, tahan terhadap asam, kedap udara, fleksibel, dan tidak rapuh. Dalam hal penggunaannya, plastik PET menempati urutan pertama. Penggunannya sekitar 72 % sebagai kemasan minuman dengan kualitas yang baik. Plastik PET merupakan poliester yang dapat dicampur dengan polimer alam seperti : sutera, wol dan katun untuk menghasilkan bahan pakaian yang bersifat tahan lama dan mudah perawatannya.
b) Plastik Polietena / Polietilena (PE)
Terdapat dua jenis plastik PE, yaitu Low Density Polyethylene (LDPE) dan High Density Polyethylene (HDPE). Plastik LDPE banyak digunakan sebagai kantung plastik serta pembungkus makanan dan barang.
Plastik HDPE banyak digunakan sebagai bahan dasar membuat mainan anak-anak, pipa yang kuat, tangki korek api gas, badan radio dan televisi, serta piringan hitam.
c) Polivinil Klorida (PVC)
Plastik PVC bersifat termoplastik dengan daya tahan kuat. Plastik ini juga bersifat tahan serta kedap terhadap minyak dan bahan organik. Ada dua tipe plastik PVC yaitu bentuk kaku dan bentuk fleksibel.
Plastik bentuk kaku digunakan untuk membuat konstruksi bangunan, mainan anak-anak, pipa PVC (paralon), meja, lemari, piringan hitam, dan beberapa komponen mobil. Adapun plastik bentuk fleksibel, jenis ini digunakan untuk membuat selang plastik dan isolasi listrik.
Dalam hal penggunaannya, plastic PVC menempati urutan ketiga dan sekitar 68 % digunakan untuk konstruksi bangunan (pipa saluran air).
d) Plastik Nilon
Plastik nilon merupakan polimer poliamida (proses pembentukannya seperti pembentukan protein). Plastik Nilon ditemukan pada tahun 1934 oleh Wallace Carothers dari Du Pont Company. Ketika itu, Carothers mereaksikan asam adipat dan heksametilendiamin. Plastik yang bersifat sangat Kuat (tidak cepat rusak) dan halus ini banyak digunakan untuk pakaian, peralatan kemah dan panjat tebing, peralatan rumah tangga serta peralatan laboratorium.
e) Karet Sintetik
Karet Sintetik yang terkenal adalah Styrene Butadiene Rubber (SBR), suatu polimer yang terbentuk dari reaksi polemerisasi antara stirena dan 1,3-butadiena. Karet sintetik ini banyak digunakan untuk membuat ban kendaraan karena memiliki kekuatan yang baik dan tidak mengembang apabila terkena minyak atau bensin.
f) Wol
Wol adalah serat alami dari protein hewani (keratin) yang tidak larut. Struktur protein wol yang lentur menghasilkan kain dengan mutu yang baik, namun kadang-kadang menimbulkan masalah karena dapat mengerut dalam pencucian. Oleh karena itu, wol dicampur dengan PET untuk menghasilkan kain yang bermutu baik dan tidak mengerut pada saat pencucian.
g) Kapas
Kapas merupakan serat alami dari bahan nabati (selulosa) yang paling banyak digunakan (hamper 50 % pemakaian serat alami berasal dari kapas). Kain katun dibuat dari serat kapas dengan perlakuan kimia sehingga menghasilkan kain yang kuat, enak dipakai, dan mudah perawatannya.
Masalah Lingkungan yang berkaitan dengan penggunaan plastic
Sekitar 20% volum sampah perkotaan berupa limbah plastic. Pada umumnya, sampah tersebut dibuang ke tempat pembuangan sampah. Oleh karena limbah plastic itu tidak dapat diuraikan oleh mikriorganisme, akibatnya kita terus-menerus memerlukan areal untuk pembuangan sampah. Meskipun tidak beracun, limbah plastic dapat menyebabkan pencemaran tanah, selain merusak pemandangan. Beberapa cara yang dapat ditempuh dalam mengatasi limbah plastic adalah dengan mendaur ulang, dengan incinerasi, dan dengan membuat plastic yang dapat mengalami biiodegradasi.
- Daur ulang
Penanganan limbah plastic yang paling ideal adalah dengan mendaur ulang. Akan tetapi, hal itu tampaknya tidak mudah dijalankan. Proses daur ulang melalui tahap-tahap pengumpalan, pemisahann (sortir) pelelehan, dan pembentukan ulang. Tahapan paling sulit adalah pengumpulan dan pemisahan. Kedua tahap ini lebih mudah dilakukan jika masyarat dengan disiplin tinggi ikut berpartisipasi, yaitu ketika membuang sampah. Plastic yang cukup banyak didaur ulang adalah jenis HDPE dan botol-botol.
2. Incinerasi
Cara lain untuk mengatasi limbah plastik adalah dengan membakarnya pada suhu tinggi (incinerasi). Limbah plastic mempunyai nilai kalor yang tinggi, sehingga dapat digunakan sebagai sumber tenaga untuk pembangkit listrik. Beberapa pembangkit listrik membakar batu bara yang dicampur dengan beberapa persen ban bekas. Pembakaran bas bekas menghasilkan asap hitam yang sangat asap hitam yang sangat pekat dan gas-gas yang bersifat korosif, pembakaran harus dilakukan pengontrolan yang baik untuk mengurangi polusi udara.
3. Plastic biodegradable
Sekitar separuh dari penggunaan plastic adalah untuk kemasan. Oleh karena telah itu, sangat baik dapat dibuat plastic yang bio- atau fotodegradable. Hal itu telah diupayakan dari mulai dipasarkan. Kebanyakan plastic biodegradable berbahan dasar zat tepung. Sayangnya, plastic jenis ini lebih mahal dan kelihatannya masyarakat enggan untuk membayar lebih.
- asam basa
Teori Asam Basa
-
A. MENURUT ARHENIUS Menurut teori Arrhenius, zat yang dalam air menghasilkan ion H + disebut asam danbasa adalah zat yang dalam air terionisasi menghasilkan ion OH – .
HCl –> H + + Cl –
NaOH –> Na + + OH –
Meskipun teori Arrhenius benar, pengajuan desertasinya mengalami hambatan berat karena profesornya tidak tertarik padanya. Desertasinya dimulai tahun 1880, diajukan pada 1883, meskipun diluluskan teorinya tidak benar. Setelah mendapat bantuan dari Van’ Hoff dan Ostwald pada tahun 1887 diterbitkan karangannya mengenai asam basa. Akhirnya dunia mengakui teori Arrhenius pada tahun 1903 dengan hadiah nobel untuk ilmu pengetahuan.
Sampai sekarang teori Arrhenius masih tetap berguna meskipun hal tersebut merupakan model paling sederhana. Asam dikatakan kuat atau lemah berdasarkan daya hantar listrik molar. Larutan dapat menghantarkan arus listrik kalau mengandung ion, jadi semakin banyak asam yang terionisasi berarti makin kuat asamnya. Asam kuat berupa elektrolit kuat dan asam lemah merupakan elektrolit lemah. Teori Arrhenius memang perlu perbaikan sebab dalam lenyataan pada zaman modern diperlukan penjelasanyang lebih bisa diterima secara logik dan berlaku secara umum. Sifat larutan amoniak diterangkan oleh teori Arrhenius sebagai berikut:
NH 4 OH –> NH 4 + + OH –
Jadi menurut Svante August Arrhenius (1884) asam adalah spesi yang mengandung H + dan basa adalah spesi yang mengandung OH –, dengan asumsi bahwa pelarut tidak berpengaruh terhadap sifat asam dan basa.
Sehingga dapat disimpulkan bahwa:
Asam ialah senyawa yang dalam larutannya dapat menghasilkan ion H + .
Basa ialah senyawa yang dalam larutannya dapat menghasilkan ion OH – .
Contoh:
1) HCl(aq) –> H + (aq) + Cl – (aq)
2) NaOH(aq) –> Na + (aq) + OH – (aq)B. MENURUT BRONSTED-LOWRY
Asam ialah proton donor, sedangkan basa adalah proton akseptor.Teori asam basa dari Arrhenius ternyata tidak dapat berlaku untuk semua pelarut, karena khusus untuk pelarut air. Begitu juga tidak sesuai dengan reaksi penggaraman karena tidak semua garam bersifat netral, tetapi ada juga yang bersifat asam dan ada yang bersifat basa.
Konsep asam basa yang lebih umum diajukan oleh Johannes Bronsted, basa adalah zat yang dapat menerima proton. Ionisasi asam klorida dalam air ditinjau sebagai perpindahan proton dari asam ke basa.
HCl + H 2 O –> H 3 O + + Cl –
Demikian pula reaksi antara asam klorida dengan amoniak, melibatkan perpindahan proton dari HCl ke NH 3 .
HCl + NH 3 ⇄ NH 4 + + Cl –
Ionisasi asam lemah dapat digambarkan dengan cara yang sama.
HOAc + H 2 O ⇄ H 3 O + + OAc –
Pada tahun 1923 seorang ahli kimia Inggris bernama T.M. Lowry juga mengajukan hal yang sama dengan Bronsted sehingga teori asam basanya disebut Bronsted-Lowry. Perlu diperhatikan disini bahwa H + dari asam bergabung dengan molekul air membentuk ion poliatomik H 3 O + disebut ion Hidronium.
Reaksi umum yang terjadi bila asam dilarutkan ke dalam air adalah:
HA + H 2 O ⇄ H 3 O + + A –
asam basa asam konjugasi basa konjugasi
Penyajian ini menampilkan hebatnya peranan molekul air yang polar dalam menarik proton dari asam.
Perhatikanlah bahwa asam konjugasi terbentuk kalau proton masih tinggal setelah asam kehilangan satu proton. Keduanya merupakan pasangan asam basa konjugasi yang terdi dari dua zat yang berhubungan satu sama lain karena pemberian proton atau penerimaan proton. Namun demikian disosiasi asam basa masih digunakan secara Arrhenius, tetapi arti yang sebenarnya harus kita fahami.
Johannes N. Bronsted dan Thomas M. Lowry membuktikan bahwa tidak semua asam mengandung ion H + dan tidak semua basa mengandung ion OH – .
Bronsted – Lowry mengemukakan teori bahwa asam adalah spesi yang memberi H + ( donor proton ) dan basa adalah spesi yang menerima H + (akseptor proton). Jika suatu asam memberi sebuah H + kepada molekul basa, maka sisanya akan menjadi basa konjugasi dari asam semula. Begitu juga bila basa menerima H + maka sisanya adalah asam konjugasi dari basa semula.
Teori Bronsted – Lowry jelas menunjukkan adanya ion Hidronium (H 3 O + ) secara nyata.
Contoh:
HF + H 2 O ⇄ H 3 O + + F –


 Asam basa asa m konjugasi basa konjugasi
Asam basa asa m konjugasi basa konjugasiHF merupakan pasangan dari F – dan H 2 O merupakan pasangan dari H 3 O + .
Air mempunyai sifat ampiprotik karena dapat sebagai basa dan dapat sebagai asam.
HCl + H 2 O –> H 3 O + + Cl –
Asam Basa
NH 3 + H 2 O ⇄ NH 4 + + OH –
Basa Asam
Manfaat dari teori asam basa menurut Bronsted – Lowry adalah sebagai berikut:
1. Aplikasinya tidak terbatas pada pelarut air, melainkan untuk semua pelarut yang mengandunh atom Hidrogen dan bahkan tanpa pelarut.
2. Asam dan basa tidak hanya berwujud molekul, tetapi juga dapat berupa anion dan kation.
Contoh lain:
1) HAc(aq) + H 2 O(l) –> H 3 O+(aq) + Ac – (aq)
asam-1 basa-2 asam-2 basa-1HAc dengan Ac – merupakan pasangan asam-basa konyugasi.
H 3 O+ dengan H 2 O merupakan pasangan asam-basa konyugasi.2) H 2 O(l) + NH 3 (aq) –> NH 4 + (aq) + OH – (aq)
asam-1 basa-2 asam-2 basa-1H 2 O dengan OH – merupakan pasangan asam-basa konyugasi.
NH 4 + dengan NH 3 merupakan pasangan asam-basa konyugasi.Pada contoh di atas terlihat bahwa air dapat bersifat sebagai asam (proton donor) dan sebagai basa (proton akseptor). Zat atau ion atau spesi seperti ini bersifat ampiprotik (amfoter).
Penulisan Asam Basa Bronsted Lowry

C. Menurut G. N. Lewis
Selain dua teori mengenai asam basa seperti telah diterangkan diatas, masih ada teori yang umum, yaitu teori asam basa yang diajukan oleh Gilbert Newton Lewis ( 1875-1946 ) pada awal tahun 1920. Lewis lebih menekankan pada perpindahan elektron bukan pada perpindahan proton, sehingga ia mendefinisikan : asam penerima pasangan elektron dan basa adalah donor pasangan elekton. Nampak disini bahwa asam Bronsted merupakan asam Lewis dan begitu juga basanya. Perhatikan reaksi berikut:
Reaksi antara proton dengan molekul amoniak secara Bronsted dapat diganti dengan cara Lewis. Untuk reaksi-reaksi lainpun dapat diganti dengan reaksi Lewis, misalnya reaksi antara proton dan ion Hidroksida:
Ternyata teori Lewis dapat lebih luas meliput reaksi-reaksi yang tidak ternasuk asam basa Bronsted-Lowry, termasuk kimia Organik misalnya:
CH 3 + + C 6 H 6 ⇄ C 6 H 6 CH 3 +

Asam ialah akseptor pasangan elektron, sedangkan basa adalah Donor pasangan elektron.
Contoh:


Asam Lewis
Model tiruan dari molekul metana, CH4. Metana merupakan salah satu contoh hidrokarbon yang masuk dalam kategori alkana, hanya mempunyai 1 jenis ikatan saja.
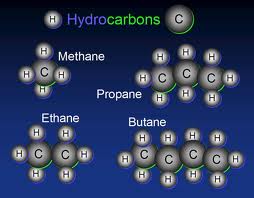
Dalam bidang kimia, hidrokarbon adalah sebuah senyawa yang terdiri dari unsur atom karbon (C) dan atom hidrogen (H). Seluruh hidrokarbon memiliki rantai karbon dan atom-atom hidrogen yang berikatan dengan rantai tersebut. Istilah tersebut digunakan juga sebagai pengertian dari hidrokarbon alifatik.
Sebagai contoh, metana (gas rawa) adalah hidrokarbon dengan satu atom karbon dan empat atom hidrogen: CH4. Etana adalah hidrokarbon (lebih terperinci, sebuah alkana) yang terdiri dari dua atom karbon bersatu dengan sebuah ikatan tunggal, masing-masing mengikat tiga atom karbon: C2H6. Propana memiliki tiga atom C (C3H8) dan seterusnya (CnH2·n+2).
Tipe-tipe hidrokarbon
Klasifikasi hidrokarbon yang dikelompokkan oleh tatanama organik adalah:
- Hidrokarbon jenuh/tersaturasi (alkana) adalah hidrokarbon yang paling sederhana. Hidrokarbon ini seluruhnya terdiri dari ikatan tunggal dan terikat dengan hidrogen. Rumus umum untuk hidrokarbon tersaturasi adalah CnH2n+2.[1] Hidrokarbon jenuh merupakan komposisi utama pada bahan bakar fosil dan ditemukan dalam bentuk rantai lurus maupun bercabang. Hidrokarbon dengan rumus molekul sama tapi rumus strukturnya berbeda dinamakan isomer struktur.[2]
- Hidrokarbon tak jenuh/tak tersaturasi adalah hidrokarbon yang memiliki satu atau lebih ikatan rangkap, baik rangkap dua maupun rangkap tiga. Hidrokarbon yang mempunyai ikatan rangkap dua disebut dengan alkena, dengan rumus umum CnH2n.[3] Hidrokarbon yang mempunyai ikatan rangkap tiga disebut alkuna, dengan rumus umum CnH2n-2.[4]
- Sikloalkana adalah hidrokarbon yang mengandung satu atau lebih cincin karbon. Rumus umum untuk hidrokarbon jenuh dengan 1 cincin adalah CnH2n.[2]
- Hidrokarbon aromatik, juga dikenal dengan arena, adalah hidrokarbon yang paling tidak mempunyai satu cincin aromatik.
Hidrokarbon dapat berbentuk gas (contohnya metana dan propana), cairan (contohnya heksana dan benzena), lilin atau padatan dengan titik didih rendah (contohnya paraffin wax dan naftalena) atau polimer (contohnya polietilena, polipropilena dan polistirena).
Ciri-ciri umum
Karena struktur molekulnya berbeda, maka rumus empiris antara hidrokarbon pun juga berbeda: jumlah hidrokarbon yang diikat pada alkena dan alkuna pasti lebih sedikit karena atom karbonnya berikatan rangkap.
Kemampuan hidrokarbon untuk berikatan dengan dirinya sendiri disebut dengan katenasi, dan menyebabkan hidrokarbon bisa membentuk senyawa-senyawa yang lebih kompleks, seperti sikloheksana atau arena seperti benzena. Kemampuan ini didapat karena karakteristik ikatan diantara atom karbon bersifat non-polar.
Sesuai dengan teori ikatan valensi, atom karbon harus memenuhi aturan “4-hidrogen” yang menyatakan jumlah atom maksimum yang dapat berikatan dengan karbon, karena karbon mempunyai 4 elektron valensi. Dilihat dari elektron valensi ini, maka karbon mempunyai 4 elektron yang bisa membentuk ikatan kovalen atau ikatan dativ.
Hidrokarbon bersifat hidrofobik dan termasuk dalam lipid.
Beberapa hidrokarbon tersedia melimpah di tata surya. Danau berisi metana dan etana cair telah ditemukan pada Titan, satelit alam terbesar Saturnus, seperti dinyatakan oleh Misi Cassini-Huygens.[5]
Hidrokarbon sederhana dan variasinya
| Jumlah atom karbon |
Alkana(1 ikatan) | Alkena(2 ikatan) | Alkuna (3 ikatan) | Sikloalkana | Alkadiena |
| 1 | Metana | Metena | Metuna | – | – |
| 2 | Etana | Etena (etilena) | Etuna (asetilena) | – | – |
| 3 | Propana | Propena (propilena) | Propuna (metilasetilena) | Siklopropana | Propadiena (alena) |
| 4 | Butana | Butena (butilena) | Butuna | Siklobutana | Butadiena |
| 5 | Pentana | Pentena | Pentuna | Siklopentana | Pentadiena (piperylene) |
| 6 | Heksana | Heksena | Heksuna | Sikloheksana | Heksadiena |
| 7 | Heptana | Heptena | Heptuna | Sikloheptana | Heptadiena |
| 8 | Oktana | Oktena | Oktuna | Siklooktana | Oktadiena |
| 9 | Nonana | Nonena | Nonuna | Siklononana | Nonadiena |
| 10 | Dekana | Dekena | Dekuna | Siklodekana | Dekadiena |
Penggunaan
Hidrokarbon adalah salah satu sumber energi paling penting di bumi. Penggunaan yang utama adalah sebagai sumber bahan bakar. Dalam bentuk padat, hidrokarbon adalah salah satu komposisi pembentuk aspal.[6]
Hidrokarbon dulu juga pernah digunakan untuk pembuatan klorofluorokarbon, zat yang digunakan sebagai propelan pada semprotan nyamuk. Saat ini klorofluorokarbon tidak lagi digunakan karena memiliki efek buruk terhadap lapisan ozon.
Metana dan etana berbentuk gas dalam suhu ruangan dan tidak mudah dicairkan dengan tekanan begitu saja. Propana lebih mudah untuk dicairkan, dan biasanya dijual di tabung-tabung dalam bentuk cair. Butana sangat mudah dicairkan, sehingga lebih aman dan sering digunakan untuk pemantik rokok. Pentana berbentuk cairan bening pada suhu ruangan, biasanya digunakan di industri sebagai pelarut wax dan gemuk. Heksana biasanya juga digunakan sebagai pelarut kimia dan termasuk dalam komposisi bensin.
Heksana, heptana, oktana, nonana, dekana, termasuk dengan alkena dan beberapa sikloalkana merupakan komponen penting pada bensin, nafta, bahan bakar jet, dan pelarut industri. Dengan bertambahnya atom karbon, maka hidrokarbon yang berbentuk linear akan memiliki sifat viskositas dan titik didih lebih tinggi, dengan warna lebih gelap.
Pembakaran hidrokarbon
Saat ini, hidrokarbon merupakan sumber energi listrik dan panas utama dunia karena energi yang dihasilkannya ketika dibakar.[7] Energi hidrokarbon ini biasanya sering langsung digunakan sebagai pemanas di rumah-rumah, dalam bentuk minyak maupun gas alam. Hidrokarbon dibakar dan panasnya digunakan untuk menguapkan air, yang nanti uapnya disebarkan ke seluruh ruangan. Prinsip yang hampir sama digunakan di pembangkit-pembangkit listrik.
Ciri-ciri umum dari hidrokarbon adalah menghasilkan uap, karbon dioksida, dan panas selama pembakaran, dan oksigen diperlukan agar reaksi pembakaran dapat berlangsung. Berikut ini adalah contoh reaksi pembakaran metana:
CH4 + 2 O2 → 2 H2O + CO2 + Energi
Jika udara miskin gas oksigen, maka akan terbentuk gas karbon monoksida (CO) dan air:
2 CH4 + 3 O2 → 2CO + 4H2O
Contoh lainnya, reaksi pembakaran propana:
C3H8 + 5 O2 → 4 H2O + 3 CO2 + Energi
CnH2n+2 + (3n+1)/2 O2 → (n+1) H2O + n CO2 + Energi
Senyawa Hidrokarbon
Senyawa hidrokarbon merupakan senyawa karbon yang paling sederhana. Dari namanya, senyawa hidrokarbon adalah senyawa karbon yang hanya tersusun dari atom hidrogen dan atom karbon. Dalam kehidupan sehari-hari banyak kita temui senyawa hidrokarbon, misalnya minyak tanah, bensin, gas alam, plastik dan lain-lain.
Sampai saat ini telah dikenal lebih dari 2 juta senyawa hidrokarbon. Untuk mempermudah mempelajari senyawa hidrokarbon yang begitu banyak, para ahli mengolongkan hidrokarbon berdasarkan susunan atom-atom karbon dalam molekulnya.
Berdasarkan susunan atom karbon dalam molekulnya, senyawa karbon terbagi dalam 2 golongan besar, yaitu senyawa alifatik dan senyawa siklik. Senyawa hidrokarbon alifatik adalah senyawa karbon yang rantai C nya terbuka dan rantai C itu memungkinkan bercabang. Berdasarkan jumlah ikatannya, senyawa hidrokarbon alifatik terbagi menjadi senyawa alifatik jenuh dan tidak jenuh.
– Senyawa alifatik jenuh adalah senyawa alifatik yang rantai C nya hanya berisi ikatan-ikatan tunggal saja. Golongan ini dinamakan alkana.
– Senyawa alifatik tak jenuh adalah senyawa alifatik yang rantai C nya terdapat ikatan rangkap dua atau rangkap tiga. Jika memiliki rangkap dua dinamakan alkena dan memiliki rangkap tiga dinamakan alkuna. Contoh senyawa hidrokarbon alifatik tak jenuh:
– Senyawa hidrokarbon siklik adalah senyawa karbon yang rantai C nya melingkar dan lingkaran itu mungkin juga mengikat rantai samping. Golongan ini terbagi lagi menjadi senyawa alisiklik dan aromatik.
- · senyawa alisiklik yaitu senyawa karbon alifatik yang membentuk rantai tertutup.
- · Senyawa aromatik yaitu senyawa karbon yang terdiri dari 6 atom C yang membentuk rantai benzena.
Sifat-Sifat Hidrokarbon
a) Sifat-Sifat Fisis
b) Sifat Kimia Berkaitan dengan reaksi kimia.
1) Reaksi-reaksi pada Alkana
Alkana tergolong zat yang sukar bereaksi sehingga disebut parafin yang artinya afinitas kecil . Reaksi terpenting dari alkana adalah reaksi pembakaran, substitusi dan perengkahan ( cracking ).
Penjelasan :
a. Pembakaran
o Pembakaran sempurna alkana menghasilkan gas CO 2 dan uap air, sedangkan pembakaran tidak sempurna menghasilkan gas CO dan uap air, atau jelaga (partikel karbon).
b. Substitusi atau pergantian
- · Atom H dari alkana dapat digantikan oleh atom lain, khususnya golongan halogen .
- · Penggantian atom H oleh atom atau gugus lain disebut reaksi substitusi .
- · Salah satu reaksi substitusi terpenting dari alkana adalah halogenasi yaitu penggantian atom H alkana dengan atom halogen, khususnya klorin ( klorinasi ).
- · Klorinasi dapat terjadi jika alkana direaksikan dengan klorin.
c. Perengkahan atau cracking
§ Perengkahan adalah pemutusan rantai karbon menjadi potongan-potongan yang lebih pendek.
§ Perengkahan dapat terjadi bila alkana dipanaskan pada suhu dan tekanan tinggi tanpa oksigen .
§ Reaksi ini juga dapat dipakai untuk membuat alkena dari alkana . Selain itu juga dapat digunakan untuk membuat gas hidrogen dari alkana .
2) Reaksi-reaksi pada Alkena
o Alkena lebih reaktif daripada alkana. Hal ini disebabkan karena adanya ikatan rangkap C=C.
o Reaksi alkena terutama terjadi pada ikatan rangkap tersebut. Reaksi penting dari alkena meliputi : reaksi pembakaran, adisi dan polimerisasi .
a. Pembakaran
§ Seperti halnya alkana, alkena suku rendah mudah terbakar. Jika dibakar di udara terbuka, alkena menghasilkan jelaga lebih banyak daripada alkana. Hal ini terjadi karena alkena mempunyai kadar C lebih tinggi daripada alkana, sehingga pembakarannya menuntut / memerlukan lebih banyak oksigen.
§ Pembakaran sempurna alkena menghasilkan gas CO 2 dan uap air.
b. Adisi (penambahan = penjenuhan)
o Reaksi terpenting dari alkena adalah reaksi adisi yaitu reaksi penjenuhan ikatan rangkap .
c. Polimerisasi
- · Adalah reaksi penggabungan molekul-molekul sederhana menjadi molekul yang besar.
- · Molekul sederhana yang mengalami polimerisasi disebut monomer , sedangkan hasilnya disebut polimer .
- · Polimerisasi alkena terjadi berdasarkan reaksi adisi .
- · Prosesnya dapat dijelaskan sebagai berikut :
ü Mula-mula ikatan rangkap terbuka sehingga terbentuk gugus dengan 2 elektron tidak berpasangan.
ü Elektron-elektron tidak berpasangan tersebut kemudian membentuk ikatan antar gugus sehingga membentuk rantai.
3) Reaksi-reaksi pada Alkuna
o Reaksi-reaksi pada alkuna mirip dengan alkena; untuk menjenuhkan ikatan rangkapnya, alkuna memerlukan pereaksi 2 kali lebih banyak dibandingkan dengan alkena.
o Reaksi-reaksi terpenting dalam alkena dan alkuna adalah reaksi adisi dengan H 2, adisi dengan halogen (X 2 ) dan adisi dengan asam halida (HX).
o Pada reaksi adisi gas HX (X = Cl, Br atau I) terhadap alkena dan alkuna berlaku aturan Markovnikov yaitu :
“ Jika atom C yang berikatan rangkap mengikat jumlah atom H yang berbeda, maka atom X akan terikat pada atom C yang sedikit mengikat atom H ”
“ Jika atom C yang berikatan rangkap mengikat jumlah atom H sama banyak, maka atom X akan terikat pada atom C yang mempunyai rantai C paling panjang “
ALKANA
o Adalah hidrokarbon alifatik jenuh yaitu hidrokarbon dengan rantai terbuka dan semua ikatan antar atom karbonnya merupakan ikatan tunggal.
o Rumus umum alkana yaitu : C n H 2n+2 ; n = jumlah atom C
Deret Homolog Alkana
Adalah suatu golongan / kelompok senyawa karbon dengan rumus umum yang sama, mempunyai sifat yang mirip dan antar suku-suku berturutannya mempunyai beda CH 2 .
Sifat-sifat deret homolog :
o Mempunyai sifat kimia yang mirip
o Mempunyai rumus umum yang sama
o Perbedaan Mr antara 2 suku berturutannya sebesar 14
o Makin panjang rantai karbon, makin tinggi titik didihnya
| rumus | nama | rumus | nama |
| CH 4 | metana | C 6 H 14 | heksana |
| C 2 H 6 | etana | C 7 H 16 | heptana |
| C 3 H 8 | propana | C 8 H 18 | oktana |
| C 4 H 10 | butana | C 9 H 20 | nonana |
| C 5 H 12 | pentana | C 10 H 22 | dekana |
Sifat-sifat Alkana
- merupakan senyawa nonpolar, sehingga tidak larut dalam air
- makin banyak atom C (rantainya makin panjang), maka titik didih makin tinggi
- pada tekanan dan suhu biasa, CH 4 – C 4 H 10 berwujud gas, C 5 H 12 – C 17 H 36 berwujud cair, diatas C 18 H 38 berwujud padat
- mudah mengalami reaksi subtitusi dengan atom-atom halogen (F 2, Cl 2, Br 2 atau I 2 )
- dapat mengalami oksidasi (reaksi pembakaran)
- Aturan tata nama alkana
- 1. Rantai tidak bercabang (lurus) Jika rantai karbon terdiri dari 4 atom karbon atau lebih, maka nama alkana diberi alawal n- (normal)
- CH3 CH2 CH2 CH2 CH3 = n-pentana
- 2. Jika rantai karbon bercabang, maka:
- a. Tentukan rantai induk, yaitu rantai karbon terpanjang dari ujung satu ke ujung yang lain. Rantai induk diberi nama alkana.
rantai induk terdiri dari 6 atom C, sehingga diberi nama heksana
- b. Penomoran. Berilan nomor pada rantai induk dari ujung terdekat cabang.
- Jika nomor dari bawah, maka cabang ada di nomor 3. tetapi jika dari kanan, maka cabang ada di nomor 4. Sehingga dipilih penomoran dari ujung bawah.
- c. Tentukan cabang, yaitu atom C yang yang terikat pada rantai induk. Cabang merupakan gugus alkil dan beri nama alkil sesuai struktur alkilnya. Perhatikan beberapa gugus alkil berikut:
- d. Tabel 3. Nama Alkil
- e. Urutan penulisan nama. Urutan penulisan nama untuk alkana bercabang: Nomor cabang-nama cabang nama rantai induk:
- Nama untuk struktur di atas adalah: 3-metilheksana
- -jika terdapat lebih dari satu alkil sejenis, maka tulis nonor-nonor cabang dari alkil sejenis dan beri awalan alkil dengan di, tri, tetra, penta dan seterusnya sesuai dengan jumlah alkil sejenis.
- -Jika terdapat dua atau lebih jenis alkil, maka nama-mana alkil disusun menurut abjad.
- 3. Tambahan untuk penomoran khusus
- a. Jika terdapat beberapa pilihan rantai induk yang sama panjang, maka pilih rantai induk yang mempunyai cabang lebih terbanyak.
- Rantai induk = 5 atom C Rantai induk = 5 atom C
- Cabang = 2 (metil dan etil) Cabang = 1 (isopropil)
- Sehingga yang dipilih adalah struktur yang pertama : 3-etil-2-metilpentana
- b. Gugus alkil dengan jumlah atom C lebih banyak diberi nomor yang lebih kecil.
25. Dari kiri, nomor 3 terdapat cabang etil
Dari kanan, nomor 3 terdapat cabang metil.
Sehingga yang dipilih adalah penomoran dari kiri: 3-etil-4metilpentana.
Alkena
o Adalah hidrokarbon alifatik tak jenuh yaitu hidrokarbon dengan satu ikatan rangkap dua (–C=C–) . Senyawa yang mempunyai 2 ikatan rangkap 2 disebut alkadiena, yang mempunyai 3 ikatan rangkap 2 disebut alkatriena dst.
o Rumus umum alkena yaitu : C n H 2n ; n = jumlah atom C
Tata Nama Alkena
1) Nama alkena diturunkan dari nama alkana yang sesuai (yang jumlah atom Cnya sama), dengan mengganti akhiran –ana menjadi –ena .
2) Rantai induk adalah rantai terpanjang yang mengandung ikatan rangkap.
3) Penomoran dimulai dari salah 1 ujung rantai induk sedemikian sehingga ikatan rangkap mendapat nomor terkecil.
4) Posisi ikatan rangkap ditunjukkan dengan awalan angka yaitu nomor dari atom C berikatan rangkap yang paling tepi / pinggir (nomor terkecil).
5) Penulisan cabang-cabang, sama seperti pada alkana.
Sumber dan Kegunaan Alkena
Alkena dibuat dari alkana melalui proses pemanasan atau dengan bantuan katalisator (cracking). Alkena suku rendah digunakan sebagai bahan baku industri plastik, karet sintetik, dan alkohol.
Alkuna
o Adalah hidrokarbon alifatik tak jenuh yaitu hidrokarbon dengan satu ikatan rangkap tiga (–C≡C–) . Senyawa yang mempunyai 2 ikatan rangkap 3 disebut alkadiuna, yang mempunyai 1 ikatan rangkap 2 dan 1 ikatan rangkap 3 disebut alkenuna .
o Rumus umum alkuna yaitu : C n H 2n-2 ; n = jumlah atom C
Tata Nama Alkuna
o Nama alkuna diturunkan dari nama alkana yang sesuai dengan mengganti akhiran –ana menjadi –una
o Tata nama alkuna bercabang sama seperti penamaan alkena.
Alkuna merupakan hidrokarbon tak jenuh yang mempunyai ikatan rangkap tiga C=C. Suku alkana yang paling kecil terdiri dari dua atom C, yaitu etuna. Nama alkuna sesuai dengan nama alkana dengan mengganti akhiran – ana menjadi -una.
| Nama | Struktur | Rumus molekul |
| Etena | CH=CH | C2H4 |
| Propena | CH=C-CH3 | C3H4 |
| Butena | CH=C-CH2-CH3 | C4H6 |
| Pentena | CH=C- CH2- CH2?-CH3 | C5H8 |
Dari tabel diatas rumus molekul secara umum dapat dirumuskan:
CnH2n-2
Manfaat Senyawa Hidrokarbon di Bidang Pangan:
Jika berbicara tentang kegunaan hidrokarbon dalam bidang pangan, maka yang dimanfaatkan bukan merupakan senyawa hidrokarbon murni, tetapi sedikit lebih luas yaitu karbohidrat. Karbohidrat merupakan senyawa karbon, hidrogen dan oksigen yang terdapat dalam alam. Banyak karbohidrat mempunyai rumus empiris CH2O (Fadholi, 2009). Banyak karbohidrat yang merupakan polimer yang tersusun dari molekul gula yang terangkai menjadi rantai yang panjang serta bercabang-cabang (Alifrizkyawan, 2010).
Karbohidrat merupakan bahan makanan penting dan sumber tenaga yang terdapat dalam tumbuhan dan daging hewan. Selain itu, karbohidrat juga menjadi komponen struktur penting pada makhluk hidup dalam bentuk serat (fiber), seperti selulosa, pektin, serta lignin. Karbohidrat menyediakan kebutuhan dasar yang diperlukan tubuh. Tubuh menggunakan karbohidrat seperti layaknya mesin mobil menggunakan bensin. Glukosa, karbohidrat yang paling sederhana mengalir dalam aliran darah sehingga tersedia bagi seluruh sel tubuh. Sel-sel tubuh tersebut menyerap glukosa. Gula ini kemudian oleh sel dioksidasi (dibakar) dengan bantuan oksigen yang kita hirup menjadi energi dan gas CO2 dalam bentuk respirasi / pernafasan. Energi yang dihasilkan dan tidak digunakan akan disimpan dibawah jaringan kulit dalam bentuk lemak (Alifrizkyawan, 2010).
Beberapa tipe dan manfaat karbohidrat adalah sebagai berikut :
1. Monosakarida
Monosakarida adalah suatu karbohidrat yang tersederhana yang tidak dapat dihidrolisis menjadi molekul karbohidrat yang lebih kecil lagi.
o Glukosa / gula anggur banyak terdapat dalam buah , jagung, dan madu.
o Fruktosa terdapat bersama dengan glukosa dan sukrosa dalam buah-buahan dan madu.
o Galaktosa, sumber dapat diperoleh dari laktosa yang dihidrolisis melalui pencernaan makanan kita (Fadholi, 2009).
2. Disakarida
Disakarida adalah suatu karbohidrat yang tersusun dari dua monosakarida. – Maltosa (glukosa + glukosa), tidak dapat difermentasi bakteri kolon dengan mudah, maka digunakan dalam makanan bayi, susu bubuk beragi (malted milk) – Laktosa (glukosa + galaktosa), terdapat dalam susu sapi dan 5-8% dalam susu ibu. – Sukrosa (glukosa + fruktosa), ialah gula pasir biasa. Bila dipanaskan akan membentuk gula invert berwarna coklat yang disebut karamel. Digunakan untuk pembuatan es krim, minuman ringan, dan permen (Fadholi, 2009).
3. Polisakarida
Polisakarida adalah suatu karbohidrat yang tersusun dari banyak monosakarida. Kegunaan hidrokarbon pada polisakarida dalam bidang pangan seperti beras, pati, jagung (Fadholi, 2009).
Senyawa hidrokarbon lain yang dapat dimanfaatkan dalam bidang pangan yaitu propilena glikol, senyawa ini merupakan senyawa yang banyak digunakan dalam bidang pangan. Dalam industri makanan, propilena glikol digunakan sebagai bahan penyedap rasa, pelarut zat warna makanan, dan humektan bahan tambahan makanan (bahan penyerap air dari udara). Propilena glikol dihasilkan dari reaksi hidrolisis propilena oksida yang diperoleh dari hasil oksidasi propilena (Muchtaridi, 2009). Berikut merupakan reaksi pembentukan propilena glikol :
2C3H6 (g) + O2 (g) → 3C3H6O (l)
C3H6O (l) + H2O (l) → HOCH2CH2OH (l)
Seyawa hidrokarbon lainnya yang juga dapat dimanfaatkan di bidang pangan adalah gas etilena dan gas asetilena (etuna). Gasetilena dan gas asetilena ini biasa digunakan untuk mempercepat pematangan buah, seperti pisang, mangga, dan melon. Gas etilena diproduksi dari cracking fraksi minyak bumi. Gas asetilen dihsilkan selama pengkarbitan, yaitu hasil reaksi karbit (CaC2) dengan air (Muchtaridi, 2009).
CaC2 (s) + 2H2O (l) HC ≡ CH (g) + Ca(OH)2 (s)
Di dalam senyawa hidrokarbon tersimpan energi kimia, kemudian memperoleh energi dari matahari untuk megadakan proses fotosintesis. Proses fotosintesis menghasilkan glukosa. Glukosa digunakan makhluk hidup sebagai sumber energi untuk melakukan aktifitas (Slamet, tt).
Hidrokarbon
Sistem koloid
Susu adalah koloid teremulsi dari lemak susu dalam air
Sistem koloid (selanjutnya disingkat “koloid” saja) merupakan suatu bentuk campuran (sistem dispersi) dua atau lebih zat yang bersifat homogen namun memiliki ukuran partikel terdispersi yang cukup besar (1 – 100 nm), sehingga terkena efek Tyndall. Bersifat homogen berarti partikel terdispersi tidak terpengaruh oleh gaya gravitasi atau gaya lain yang dikenakan kepadanya; sehingga tidak terjadi pengendapan, misalnya. Sifat homogen ini juga dimiliki oleh larutan, namun tidak dimiliki oleh campuran biasa (suspensi).
Koloid adalah suatu campuran zat heterogen antara dua zat atau lebih di mana partikel-partikel zat yang berukuran koloid tersebar merata dalam zat lain. Ukuran koloid berkisar antara 1-100 nm ( 10-7 – 10-5 cm ).
Contoh:
Mayones dan cat, mayones adalah campuran homogen di air dan minyak dan cat adalah campuran homogen zat padat dan zat cair.
Koloid mudah dijumpai di mana-mana: susu, agar-agar, tinta, sampo, serta awan merupakan contoh-contoh koloid yang dapat dijumpai sehari-hari. Sitoplasma dalam sel juga merupakan sistem koloid. Kimia koloid menjadi kajian tersendiri dalam kimia industri karena kepentingannya.
Macam-macam koloid
Koloid memiliki bentuk bermacam-macam, tergantung dari fase zat pendispersi dan zat terdispersinya. Beberapa jenis koloid:
- Aerosol yang memiliki zat pendispersi berupa gas. Aerosol yang memiliki zat terdispersi cair disebut aerosol cair (contoh: kabut dan awan) sedangkan yang memiliki zat terdispersi padat disebut aerosol padat (contoh: asap dan debu dalam udara).
- Sol Sistem koloid dari partikel padat yang terdispersi dalam zat cair. (Contoh: Air sungai, sol sabun, sol detergen dan tinta).
- Emulsi Sistem koloid dari zat cair yang terdispersi dalam zat cair lain, namun kedua zat cair itu tidak saling melarutkan. (Contoh: santan, susu, mayonaise, dan minyak ikan).
- Buih Sistem Koloid dari gas yang terdispersi dalam zat cair. (Contoh: pada pengolahan bijih logam, alat pemadam kebakaran, kosmetik dan lainnya).
- Gel sistem koloid kaku atau setengah padat dan setengah cair. (Contoh: agar-agar, Lem).
Sifat-sifat Koloid
- Efek Tyndall
Efek Tyndall ialah gejala penghamburan berkas sinar (cahaya) oleh partikel-partikel koloid. Hal ini disebabkan karena ukuran molekul koloid yang cukup besar. Efek tyndall ini ditemukan oleh John Tyndall (1820-1893), seorang ahli fisika Inggris. Oleh karena itu sifat itu disebut efek tyndall.
Efek tyndall adalah efek yang terjadi jika suatu larutan terkena sinar. Pada saat larutan sejati disinari dengan cahaya, maka larutan tersebut tidak akan menghamburkan cahaya, sedangkan pada sistem koloid, cahaya akan dihamburkan. hal itu terjadi karena partikel-partikel koloid mempunyai partikel-partikel yang relatif besar untuk dapat menghamburkan sinar tersebut. Sebaliknya, pada larutan sejati, partikel-partikelnya relatif kecil sehingga hamburan yang terjadi hanya sedikit dan sangat sulit diamati.
- Gerak Brown
Gerak Brown ialah gerakan partikel-partikel koloid yang senantiasa bergerak lurus tapi tidak menentu (gerak acak/tidak beraturan). Jika kita amati koloid dibawah mikroskop ultra, maka kita akan melihat bahwa partikel-partikel tersebut akan bergerak membentuk zigzag. Pergerakan zigzag ini dinamakan gerak Brown. Partikel-partikel suatu zat senantiasa bergerak. Gerakan tersebut dapat bersifat acak seperti pada zat cair dan gas( dinamakan gerak brown), sedangkan pada zat padat hanya beroszillasi di tempat ( tidak termasuk gerak brown ). Untuk koloid dengan medium pendispersi zat cair atau gas, pergerakan partikel-partikel akan menghasilkan tumbukan dengan partikel-partikel koloid itu sendiri. Tumbukan tersebut berlangsung dari segala arah. Oleh karena ukuran partikel cukup kecil, maka tumbukan yang terjadi cenderung tidak seimbang. Sehingga terdapat suatu resultan tumbukan yang menyebabkan perubahan arah gerak partikel sehingga terjadi gerak zigzag atau gerak Brown.
Semakin kecil ukuran partikel koloid, semakin cepat gerak Brown yang terjadi. Demikian pula, semakin besar ukuran partikel koloid, semakin lambat gerak Brown yang terjadi. Hal ini menjelaskan mengapa gerak Brown sulit diamati dalam larutan dan tidak ditemukan dalam campuran heterogen zat cair dengan zat padat (suspensi). Gerak Brown juga dipengaruhi oleh suhu. Semakin tinggi suhu sistem koloid, maka semakin besar energi kinetik yang dimiliki partikel-partikel medium pendispersinya. Akibatnya, gerak Brown dari partikel-partikel fase terdispersinya semakin cepat. Demikian pula sebaliknya, semakin rendah suhu sistem koloid, maka gerak Brown semakin lambat.
- Adsorpsi
Adsorpsi ialah peristiwa penyerapan partikel atau ion atau senyawa lain pada permukaan partikel koloid yang disebabkan oleh luasnya permukaan partikel. (Catatan : Adsorpsi harus dibedakan dengan absorpsi yang artinya penyerapan yang terjadi di dalam suatu partikel). Contoh : (i) Koloid Fe(OH)3 bermuatan positif karena permukaannya menyerap ion H+. (ii) Koloid As2S3 bermuatan negatif karena permukaannya menyerap ion S2.
- Muatan koloid
Dikenal dua macam koloid, yaitu koloid bermuatan positif dan koloid bermuatan negatif.
- Koagulasi koloid
Koagulasi adalah penggumpalan partikel koloid dan membentuk endapan. Dengan terjadinya koagulasi, berarti zat terdispersi tidak lagi membentuk koloid. Koagulasi dapat terjadi secara fisik seperti pemanasan, pendinginan dan pengadukan atau secara kimia seperti penambahan elektrolit, pencampuran koloid yang berbeda muatan.
- Koloid pelindung
Koloid pelindung ialah koloid yang mempunyai sifat dapat melindungi koloid lain dari proses koagulasi.
- Dialisis
Dialisis ialah pemisahan koloid dari ion-ion pengganggu dengan cara ini disebut proses dialisis. Yaitu dengan mengalirkan cairan yang tercampur dengan koloid melalui membran semi permeable yang berfungsi sebagai penyaring. Membran semi permeable ini dapat dilewati cairan tetapi tidak dapat dilewati koloid, sehingga koloid dan cairan akan berpisah.
- Elektroforesis
Elektroferesis ialah peristiwa pemisahan partikel koloid yang bermuatan dengan menggunakan arus listrik
Contoh aplikasi koloid:
| Jenis industri | Contoh aplikasi |
| Industri makanan | Keju, mentega, susu, saus salad |
| Industri kosmetika dan perawatan tubuh | Krim, pasta gigi, sabun |
| Industri cat | Cat |
| Industri kebutuhan rumah tangga | Sabun, deterjen |
| Industri pertanian | Peptisida dan insektisida |
| Industri farmasi | Minyak ikan, pensilin untuk suntikan |
Jenis – jenis koloid
1. Sol (fase terdispersi padat)
a) Sol padat adalah sol dalam medium pendispersi padat
Contoh: paduan logam, gelas warna, intan hitam
b) Sol cair adalah sol dalam medium pendispersi cair
Contoh: cat, tinta, tepung dalam air, tanah liat
c) Sol gas adalah sol dalam medium pendispersi gas
Contoh: debu di udara, asap pembakaran
2. Emulsi (fase terdispersi cair)
a) Emulsi padat adalah emulsi dalam medium pendispersi padat
Contoh: Jelly, keju, mentega, nasi
b) Emulsi cair adalah emulsi dalam medium pendispersi cair
Contoh: susu, mayones, krim tangan
c) Emulsi gas adalah emulsi dalam medium pendispersi gas
Contoh: hairspray dan obat nyamuk
3. BUIH (fase terdispersi gas)
a) Buih padat adalah buih dalam medium pendispersi padat
Contoh: Batu apung, marshmallow, karet busa, Styrofoam
b) Buih cair adalah buih dalam medium pendispersi cair
Contoh: putih telur yang dikocok, busa sabun
Untuk pengelompokan buih, jika fase terdispersi dan medium pendispersi sama-sama berupa gas, campurannya tergolong larutan
EXPERIMENT
Apa yang telah dibahas dalam subtopik ini dapat dibuktikan slah satunya dengan sebuah eksperimen seperti yang di bawah ini:
Tujuan:
mempelajari berbagai jenis campuran
Alat dan Bahan:
Gelas kimia (100ml)
Pengaduk corong kertas saring
Gula pasir
Terigu
Susub instant
Ureasabun
Serbuk belereng
Air suling
Cara kerja:
1. Isilah 6 gelas kimia dengan 50 ml air suling
2. Tambahkan:
a. 1 sendok teh gula pasir dalam gelas-1
b. 1 sendok teh terigu dalam gelas-2
c. 1 sendok teh susu instan dalam gelas-3
d. 1 sendok teh urea dalam gelas-4
e. 1 sendok teh sabun dalam gelas-5
f. 1 sendok teh serbuk belerang dalam gelas-6
3. Aduklah setiap campuran. Perhatikanlah apakah zat yang dicampurkan larut atau tidak.
4. Diamkan campuran tersebut. Catat apakah campuran itu stabil atau tidak stabil;bening atau keruh
5. Saringlah setipa campuran. Catat manakah yang meninggalkan redisu dan apakah hasil penyaringan bening atau keruh.
Hasil Pengamatan:
Sifat campuran Campuran air dengan
Gula Terigu Susu Urea Sabun Belerang
Kelarutan
Kestabilan
Bening/keruh
Residu
Filtrat
Bening/keruh
Diskusi:
– Campuran –campuran tersebut termasuk dalam larutan, sejati, koloid atau suspensi
– Kesimpulan dari percobaan di atas
Campuran air dan gula akan membentuk larutan gula. Zat terlarut tidak tampak lagi, tersebar dalam bentuk partikel-partikel yang sangat kecil. Larutan merupakan campuran homogen, stabil dan tidak dapat disaring. Susu dengan air membentuk larutan yang keruh. Jika didiamkan campuran tidak menghasilkan endapan dan larutan keruh tersebut tidak dapat dipisahkan dengan penyaringan. Campuran ini homogen terdiri atas dua fasa. Tepung dan air, membentuk endapan dari tepung yna tidak larut. Larutan bersifat homogen dan dapat dipisahkan dengan penyaringan. Dari pengamatan ini menunjukkan bahwa ukuran patikel-partikel yang terdispersi dalam suatu campuran menentukan jenis dan sifat campuran tersebut. Karena perbedaan ukuran partikel terdispersi tersebut maka larutan dan koloid sama-sama tercampur homogen, dapat dibedakan dengan kertas selofan. Partikel larutan dapat menembus kertas selofan sedangkan partikel-partikel koloid tidak. Besarnya partikel terdispersi merupakan faktor penentu dari sifat atau keadaan campuran (larutan, koloid atau suspensi).
Beberapa partikel koloid memperoleh muatan dari proses ionisasi gugus yang ada pada permukaan partikel koloid. Contohnya adalah koloid protein dan koloid sabun/ deterjen.
a. Pada koloid protein:
Koloid ini adalah jenis sol yang mempunyai gugus yang bersifat asam (-COOH) dan basa (-NH2). Kedua gugus ini dapat terionisasi dan memberikan muatan pada molekul-molekul protein.
Pada pH rendah (konsentrasi H+ tinggi), gugus basa –NH2 akan menerima proton (H+) dan membentuk gugus –NH3+
NH2 + H+ → -NH3+
Pada pH tinggi, -COOH akan mendonorkan proton H+ dan membentuk gugus –COO–
COOH + H+ → –COO–
Maka, partikel sol protein bermuatan positif pada pH rendah dan bermuatan negatif pada pH tingi. Pada titik pH isoelektrik, partikel-partikel protein bermuatan netral karena muatan -NH3+ –COO– saling meniadakan menjadi netral.
b. Pada koloid sabun / deterjen
Molekul sabun dan deterjen lebih kecil daripada molekul koloid. Pada konsentrasi relatif pekat, kedua molekul ini dapat bergabung dan membentuk partikel-partikel berukuran koloid yang disebut misel. Lalu zat-zat yang tergabung dalam suatu fase pendispersi dan membentuk partikel-partikel berukuran koloid disebut koloid terasosiasi.
Sabun adalah garam karboksilat dengan partikel R-COO–Na+. Di dalam air partikel ini akan terionisasi.
R-COO–Na+ → R-COO– + Na+
Anion
Anion-anion R-COO– akan bergabung membentuk misel. Gugus R- tidak larut dalam air sehingga akan terorientasi ke pusat, sedangkan COO– larut dalam air sehingga berada di permukaan yang bersentuhan dengan air.
b. Kestabilan Koloid
Partikel-partikel koloid ialah bermuatan sejenis. Maka terjadi gaya tolak-menolak yang mencegah partikel-partikel koloid bergabung dan mengendap akibat gaya gravitasi. Oleh karena itu, selain gerak Brown, muatan koloid juga berperan besar dalam menjaga kestabilan koloid.
c. Lapisan Bermuatan Ganda
Pada awalnya, partikel-partikel koloid mempunyai muatan yang sejenis yang didapatkannya dari ion yang diadsorpsi dari medium pendispersinya. Apabila dalam larutan ditambahkan larutan yang berbeda muatan dengan system koloid, maka sistem koloid itu akan menarik muatan yang berbeda tersebut sehingga membentuk lapisan ganda. Lapisan pertama ialah lapisan padat di mana muatan partikel koloid menarik ion-ion dengan muatan berlawanan dari medium pendispersi. Sedangkan lapisan kedua berupa lapisan difusi dimana muatan dari medium pendispersi terdifusi ke partikel koloid. Model lapisan berganda tersebut tijelaskan pada lapisan ganda Stern. Adanya lapisan ini menyebabkan secara keseluruhan bersifat netral.
d. Elektroforesis
Oleh karena partikel sol bermuatan listrik, maka partikel ini akan bergerak dalam medan listrik. Pergerakan ini disebut elektroforesis. Untuk lebih jelas, mari kita lihat tabung berikut di samping.
Pada gambar, terlihat bahwa partikel-partikel koloid bermuatan positif tersebut bergerak menuju elektrode dengan muatan berlawanan, yaitu elektrode negatif. Jika sistem koloid bermuatan negatif, maka partikel itu akan menuju elektrode positif
e. Koagulasi
Jika partikel-partikel koloid tersebut bersifat netral, maka akan terjadi penggumpalan dan pengendapan karena pengaruh gravitasi. Proses penggumpalan dan pengendapan ini disebut koagulasi.
Penetralan partikel koloid dapat dilakukan dengan 4 cara, yaitu:
1. Menggunakan prinsip elektroforesis
Proses elektroforesis adalah pergerakan partikel-partikel koloid yang bermuatan ke elektrode dengan muatan berlawanan. Ketika partikel ini mencapai elektrode, maka system koloid akan kehilangan muatannya dan bersifat netral.
2. Penambahan koloid lain dengan muatan berlawanan
Ketika koloid bermuatan positif dicampur dengan koloid bermuatan negatif, maka muatan tersebut akan saling menghilang dan bersifat netral.
3. Penambahan elektrolit
Jika suatu elektrolit ditambahkan pada system koloid, maka partikel koloid yang bermuatan negatif akan mengasorpsi ion positif (kation) dari elektrolit. Begitu juga sebaliknya, partikel positif akan mengasorpsi ion negative (anion) dari elektrolit. Dari adsorpsi diatas, maka terjadi proses koagulasi.
4. Pendidihan
Kenaikan suhu sistem koloid menyebabkan jumlah tumbukan antara partikel-partikel sol dengan molekul-molekul air bertambah banyak. Hal ini melepaskan elektrolit yang teradsorpsi pada permukaan koloid. Akibatnya partikel tidak bermuatan.
f. Koloid pelindung
Sistem koloid di mana partikel terdispersinya mempunyai daya adsorpsi relatif besar disebut koloid liofil yang bersifat lebih stabil. Sedangkan jika partikel terdispersinya mempunyai gaya absorpsi yang cukup kecil, maka disebut koloid liofob yang bersifat kurang stabil. Yang berfungsi sebagai koloid pelindung ialah koloid liofil.
Sol liofob/ hidrofob mudah terkoagulasi dengan sedikit penambahan elektrolit, tetapi menjadi lebih stabil jika ditambahkan koloid pelindung yaiut koloid liofil. Berikut ini penjelasan yang lebih lengkap mengenai koloid liofil dan liofob:
– Koloid liofil (suka cairan) adalah koloid di mana terdapat gaya tarik-menarik yang cukup besar
antara fase terdispersi dan medium pendispersi. Contoh, disperse kanji, sabun, deterjen.
– Koloid liofob (tidak suka cairan) adalah koloid di mana terdapat gaya tarik-menarik yang lemah atau
bahkan tidak ada sama sekali antar fase terdispersi dan medium pendispersinya. Contoh, disperse
emas, belerang dalam air.
Kelas : X
Program : Inti
Semester : 1 (Ganjil)
Waktu : 8 x 45 Menit
3. Memahami sifat-sifat larutan elektrolit dan non elektrolit, serta Reaksi oksidasi dan reduksi
3.1. Mengidentifikasi sifat larutan elektrolit dan non-elektrolit berdasarkan data pada hasil percobaan 3.2. menjelaskan perkembangan konsep reaksi oksidasi-reduksi dan hubungannya dengan tata nama senyawa serta penerapannya.
|
SUB MATERI POKOK I : LARUTAN ELEKTROLIT DAN NON ELEKTROLIT
A. Apakah Larutan Itu?
Masih ingatkah Anda, apakah larutan itu?
Tentunya Anda masih ingat bukan? Larutan adalah campuran yang bersifat homogen atau serbasama. Jika Anda melarutkan 2 sendok makan gula putih (pasir) ke dalam segelas air, maka Anda telah mendapatkan larutan gula.
Terdapat 2 larutan yaitu: larutan Elektrolit dan Larutan Non-Elektrolit.
1.1 Larutan Elektrolit
Larutan elektrolit merupakan larutan yang dibentuk dari zat elektrolit. Sedangkan zat elektrolit itu sendiri merupakan zat-zat yang di dalam air terurai membentuk ion-ionnya. Zat elektrolit yang terurai sempurna di dalam air disebut Elektrolit Kuat dan larutan yang dibentuknya disebut Larutan Elektrolit Kuat. Zat elektrolit yang hanya terurai sebagian membentuk ion-ionnya di dalam air disebut Elektrolit Lemah dan larutan yang dibentuknya disebut Larutan Elektrolit Lemah.
1.2 Larutan Non-Elektrolit
Larutan non elektrolit merupakan larutan yang dibentuk dari zat non elektrolit. Sedangkan zat non elektrolit itu sendiri merupakan zat-zat yang di dalam air tidak terurai dalam bentuk ion-ionnya, tetapi terurai dalam bentuk molekuler.
1.3 Membedakan Larutan Elektrolit dan Larutan Non Elektrolit
Larutan elektolit dan non elektrolit dapat dibedakan dengan jelas dari sifatnya yaitu penghantaran Listrik.
Gambar 1: Percobaan daya hantar listrik suatu benda
a). Larutan elektrolit dapat menghantarkan listrik.
Hal ini untuk pertama kalinya diterangkan oleh Svante August Arrhenius(1859-1927), seorang ilmuwan dari Swedia. Arrhenius menemukan bahwa zat elektrolit dalam air akan terurai menjadi partikel-partikel berupa atom atau gugus atom yang bermuatan listrik. Karena secara total larutan tidak bermuatan, maka jumlah muatan positif dalam larutan harus sama dengan muatan negatif. Atom atau gugus atom yang bermuatan listrik itu dinamai ion. Ion yang bemuatan positif disebut kation, sedangkan ion yang bermuatan negatif disebut anion. Pembuktian sifat larutan elektrolit yang dapat menghantarkan listrik ini dapat diperlihatkan melalui eksperimen. Zat-zat yang tergolong elektrolit yaitu asam, basa, dan garam.
Contoh larutan elektrolit kuat : HCl, HBr, HI, HNO3
Contoh larutan elektrolit lemah :CH3COOH, Al(OH)3 dan Na2CO3
b). Larutan non elektrolit tidak dapat menghantarkan listrik
Adapun larutan non elektrolit terdiri atas zat-zat non elektrolit yang tidak dilarutkan ke dalam air tidak terurai menjadi ion ( tidak terionisasi ). Dalam larutan, mereka tetap berupa molekul yang tidak bermuatan listrik. Itulah sebabnya larutan non elektrolit tidak dapat menghantarkan listrik. Pembuktian sifat larutan non elektrolit yang tidak dapat menghantarkan listrik ini dapat diperlihatkan melalui eksperimen.
Contoh larutan non elektrolit : Larutan Gula (C12H22O11), Etanol (C2H5OH), Urea (CO(NH)2), Glukosa (C6H12O6), dan lain-lain
1.4 Kekuatan Elektrolit
Kekuatan suatu elektrolit ditandai dengan suatu besaran yang disebut derajat ionisasi (α)
Keterangan :
Elektrolit kuat memiliki harga α = 1, sebab semua zat yang dilarutkan terurai menjadi ion.
Elektrolit lemah memiliki harga α<1, sebab hanya sebagian yang terurai menjadi ion.
Adapun non elektrolit memiliki harga α = 0, sebab tidak ada yang terurai menjadi ion.
Elektrolit kuat : α = 1(terionisasi sempurna)
Elektrolit lemah : 0 < α < 1 (terionisasi sebagian)
Non Elektrolit : α = 0 (tidak terionisasi)
1.5 Reaksi Ionisasi Elektrolit Kuat
Larutan yang dapat memberikan lampu terang, gelembung gasnya banyak, maka laurtan ini merupakan elektrolit kuat. Umumnya elektrolit kuat adalah larutan garam. Dalam proses ionisasinya, elektrolit kuat = 1 (terurai senyawa), pada persamaanamenghasilkan banyak ion maka reaksi ionisasi elektrolit kuat ditandai dengan anak panah satu arah ke kanan. Perlu diketahui pula elektrolit kuat ada beberapa dari asam dan basa.
Gambar 1:1.5 ; contoh larutan elektrolit
Contoh :
NaCl (aq)
KI (aq)
Ca(NO3)2(g) + Na+(aq) + Cl–(aq)
K+(aq) + I–(aq)
Ca2+(aq) + NO3-(aq)
Di bawah ini diberikan kation dan anion yang dapat membentuk elektrolit kuat.
Kation : Na+, Li+, K+, Mg2+, Ca2+, Sr2+, Ba2+, NH4+
Anion : Cl–, Br–, I–, SO42-, NO3-, ClO4-, HSO4-, CO32-, HCO32-
Cobalah Anda buatkan 5 macam garam lengkap dengan reaksi ionisasinya sesuai dengan kation dan anion pembentuknya seperti di bawah ini.
No. Kation dan Anion Rumus Senyawa Reaksi Kimia
1. Mg2+Br–
2. Na+SO42-
3. Ca2+ClO4-
4. Ba2+NO32-
5. NH4+Cl-
Jawaban :
1). Mg2+ 2). Na+
Br– SO42-
MgBr2 Na2SO4
Mg2+ + 2Br– 2Na+ + SO42-
4 2- 2+
3). Ca2+ 4). Ba2+
ClO4– NO32-
Ca(ClO4)4 Ba(NO3)2
Ca2+ + 2ClO4– Ba2+ + 2NO3–
5). NH4+
Cl–
NH4Cl
NH4+ + Cl–
1.6 Reaksi Ionisasi Elektrolit Lemah
Larutan yang dapat memberikan nyala redup ataupun tidak menyala, tetapi masih terdapat gelembung gas pada elektrodanya maka larutan ini merupakan elekrtolit lemah. Daya hantarnya buruh dan memiliki á (derajat ionisasi) kecil, karena sedikit larutan yang terurai (terionisasi). Makin sedikit yang terionisasi, makin lemah elektrolit tersebut. Dalam persamaan reaksi ionisasi elektrolit lemah ditandai dengan panah dua arah (bolak-balik) artinya tidak semua molekul terurai (ionisasi tidak sempurna)
Contoh:
CH3COOH(aq)
NH4OH(g) CH3COO-(aq) + H+(aq)
NH4+(aq) + OH-(aq)
Di bawah ini diberikan beberapa larutaan elektrolit lemah, tuliskanlah reaksi ionisasinya.
a. H2S(aq)
b. H3PO4 (aq)
c. HF(g)
d. HCOOH(aq)
e. HCN(aq)
Jawaban :
a. H2S(aq) → 2H+(aq) + S2-(aq)
b. H3PO4 (aq) → 3H+(aq) + PO43-(aq
c. HF(g) → H+(aq) + F-(aq)
d. HCOOH(aq) → H+(aq) + HCOO+(aq)
Kegiatan 6.1 Melakukan Percobaan
Daya Hantar Listrik Larutan
Cara kerja :
1. Susunlah alat penguji elektrolit sehingga berfungsi dengan baik.
2. Masukkan ± 50 ml air suling ke dalam gelas kimia, kemudian uji daya hantarnya. Catat apakah lampu menyala atau timbul gelembung pada electrode
3. Bersihkan electrode dengan air dan keringkan. Dengan cara yang sama, ujilah daya hantar larutan yang tersedia, misalnya :
o Larutan garam dapur
o Larutan asam klorida
o Larutan asam sulfat
o Larutan natrium hodroksida
o Larutan gula
o Larutan asam cuka
o Air sumur
o Air ledeng
Analisis data/ pertanyaan :
1. Gejala apakah yang menandai hantaran listrik melalui larutan?
Jawab:………………………………………………………………………………………………………………………………………………………
2. Kelompokkan bahan-bahan yang diuji ke dalam elektrolit dan noneleltrolit
Jawab:………………………………………………………………………………………………………………………………………………………
3. Tariklah kesimpulan dari percobaan di atas.
Jawab:………………………………………………………………………………………………………………………………………………………
|
1. Apa yang dimaksud dengan :
a. larutan elektrolit
b. larutan non elektrolit
Jawab:……………………………………………………………………………………………………………………………………………………………
2. Bagaimana cara menentukan apakah suatu larutan tergolong elektrolit atau non elektrolit? Jelaskan.
Jawab:……………………………………………………………………………………………………………………………………………………………
3. Sebutkan tiga contoh larutan elektrolit dan tiga contoh larutan nonelektrolit dalam kehidupan sehari-hari.
Jawab:……………………………………………………………………………………………………………………………………………………………
2. TEORI ION SVANTE ARRHENIUS
Cara Larutan Elektrolit Menghantarkan Arus Listrik
Pada tahun 1884, Svante Arrhenius, ahli kimia terkenal dari Swedia mengemukakan teori elektrolit yang sampai saat ini teori tersebut tetap bertahan padahal ia hampir saja tidak diberikan gelar doktornya di Universitas Upsala, Swedia, karena mengungkapkan teori ini. Menurut Arrhenius, larutan elektrolit dalam air terdisosiasi ke dalam partikel-partikel bermuatan listrik positif dan negatif yang disebut ion (ion positif dan ion negatif) Jumlah muatan ion positif akan sama dengan jumlah muatan ion negatif, sehingga muatan ion-ion dalam larutan netral. Ion-ion inilah yang bertugas mengahantarkan arus listrik.
” Larutan elektrolit dapat menghantarkan listrik karena mengandung ion-ion yang dapat bergerak bebas. Ion-ion itulah yang menghantarkan arus listrik melalui larutan”. Larutan yang dapat menghantarkan arus listrik disebut larutan elektrolit. Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan.
Larutan yang dapat menghantarkan arus listrik disebut larutan elektrolit.
Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan. Larutan elektrolit mengandung partikel-partikel yang bermuatan (kation dan anion). Berdasarkan percobaan yang dilakukan oleh Michael Faraday, diketahui bahwa jika arus listrik dialirkan ke dalam larutan elektrolit akan terjadi proses elektrolisis yang menghasilkan gas. Gelembung gas ini terbentuk karena ion positif mengalami reaksi reduksi dan ion negatif mengalami oksidasi.
Contoh, pada laruutan HCl terjadi reaksi elektrolisis yang menghasilkan gas hidrogen sebagai berikut.
HCl(aq)→ H+(aq) + Cl–(aq)
Reaksi reduksi : 2H+(aq) + 2e– → H2(g)
Reaksi oksidasi : 2Cl–(aq) → Cl2(g) + 2e–
Larutan elektrolit terdiri dari larutan elektrolit kuat contohnya HCl, H2SO4, dan larutan elektrolit lemah contohnya CH3COOH, NH3, H2S.
Larutan elektrolit dapat bersumber dari senyawa ion (senyawa yang mempunyai ikatan ion) atau senyawa kovalen polar (senyawa yang mempunyai ikatan kovalen polar)
Zat elektrolit yang terurai dalam air menjadi ion-ion :
NaCl (s) → Na+ (aq) + Cl– (aq)
HCl (g) →H+ (aq) + Cl– (aq)
H2SO4 (aq) → 2H+ (aq) + SO4 2- (aq)
NaOH (s) →Na+ (aq) + OH– (aq)
CH3COOH (l) →CH3COO– (aq) + H+ (aq)
Zat non elektrolit yang tidak terurai menjadi ion-ion, tapi tetap berupa molekul
C2H5OH (l)→ C2H5OH (aq)
CO(NH2)2 (s) →CO(NH2)2 (aq)
Reaksi peruraian disebut elektrolisis
Reaksi reduksi : pada katode, elektron ditangkap oleh ion
Reaksi oksidasi : pada anode, ion akan melepaskan electron
Berdasarkan pelepasan dan pengikatan oksigen
Reaksi oksidasi : reaksi pengikatan oksigen
Contoh : C6H12O6 → CO2 + 6H2O
3S + 2KClO3 → 2KCl + 3SO2
Reaksi Reduksi :Reaksi pelepasan oksigen
Contoh : Fe2O3 + 3CO →2Fe2 + 3CO2
CuO + H2→Cu + H2O
3. Hubungan Keelektrolitan dengan ikatan kimia
3.1 Senyawa Ion
Sebagai contoh dari kegiatan percobaan yang tergolong larutan elektrolit yang berikatan ion adalah garam dapur.
Dapatkah Anda membedakan daya hantar listrik untuk garam pada saat kristal, lelehan dan larutan?
Cobalah perhatikan uraian berikut:
NaCl adalah senyawa ion, jika dalam keadaan kristal sudah sebagai ion-ion, tetapi ion-ion itu terikat satu sama lain dengan rapat dan kuat, sehingga tidak bebas bergerak. Jadi dalam keadaan kristal (padatan) senyawa ion tidak dapat menghantarkan listrik, tetapi jika garam yang berikatan ion tersebut dalam keadaan lelehan atau larutan, maka ion-ionnya akan bergerak bebas, sehingga dapat menghantarkan listrik.
Pada saat senyawa NaCl dilarutkan dalam air, ion-ion yang tersusun rapat dan terikat akan tertarik oleh molekul-molekul air dan air akan menyusup di sela-sela butir-butir ion tersebut (proses hidasi) yang akhirnya akan terlepas satu sama lain dan bergerak bebas dalam larutan. Yang termasuk ke dalam senyawa ion adalah senyawa basa dan garam.
NaCl (s) + air Na+ (aq) + Cl-(aq)
Gambar 5. Proses pelarutan padatan Kristal
3.2 Senyawa Kovalen
Senyawa kovalen terbagi menjadi senyawa kovalen non polar misalnya : F2, Cl2, Br2, I2, CH4 dan kovalen polar misalnya : HCl, HBr, HI, NH3.
Dari hasil percobaan, hanya senyawa yang berikatan kovalen polarlah yang dapat menghantarkan arus listrik. Bagaimanakah hal ini dapat dijelaskan?
Kalau kita perhatikan, bahwa HCl merupakan senyawa kovalen di atom bersifat polar, pasangan elektron ikatan tertarik ke atom Cl yang lebih elektro negatif dibanding dengan atom H. Sehingga pada HCl, atom H lebih positif dan atom Cl lebih negatif.
Struktur lewis:
Reaksi ionisasi nya adalah sebagai berikut :
HCL(aq) → H+(aq) + Cl-(aq)
Jadi walaupun molekul HCl bukan senyawa ion, jika dilarutkan ke dalam air maka larutannya dapat menghantarkan arus listrik karena menghasilkan ion-ion yang bergerak bebas.
Apakah HCl dalam keadaan murni dapat menghantarkan arus listrik? Karena HCl dalam keadaan murni berupa molekul-molekul tidak mengandung ion-ion, maka cairan HCl murni tidak dapat menghantarkan arus listrik.
Dari penjelasan di atas maka dapat disimpulkan bahwa suatu larutan akan dapat menghantarkan listrik apabila lrutan tersebut memiliki ion-ion yang bergerak bebas, tapi apabila ion-ion berbentuk rapat dan kuat, sehingga tidak dapat bergerak bebas maka larutan tersebut tidak dapat menghantarkan listrik.
Perbadaan antara elektrolit senyawa ion dengan senyawa kovalen polar disimpulkan sebagai berikut :
| Daya hantar listrikJenis elektrolit |
padatan |
lelehan |
larutan |
| Senyawa ionSenyawa kovalen polar | NonkonduktorNonkonduktor | KonduktorNonkonduktor | KonduktorKonduktor |
|
Uji kepemahan Anda |
A. Jawablah pertanyaan-pertanyaan di bawah ini dengan jawaban yang benar dan tepat !
|
1. |
Senyawa di bawah ini apabila dilarutkan dalam air terionisasi sempurna …. a. amoniak b. alkohol c. cuka d. garam dapur e. gula |
|
2. |
Beberapa senyawa berikut : 1. NaCl 2. HCl 3. CH3COOH 4. NaOH 5. C2H5OH Senyawa kovalen yang dapat menghantarkan arus listrik adalah …… a. 1 dan 2 b. 2 dan 3 c. 1 dan 4 d. 3 dan 5 e. 2 dan 5 |
|
3. |
Dari larutan berikut ini yang diharapkan menghantar arus listrik yang paling baik adalah … a. larutan urea 1M b. larutan asam cuka 0,1 M c. larutan asam cuka 1 M d. larutan H2SO4 0,1 M e. larutan H2SO4 1 M |
|
4. |
Pada penghantaran listrik melalui HCl ion-ion H+ akan bergerak untuk mengambil elekron ke arah …. a. anoda b. katoda c. kation d. anion e. elektrode |
|
5. |
Kristal senyawa ionik mempunyai ion-ion yang tidak dapat bergerak bebas. Ion-ion ini dapat bergerak bebas jika … a. didinginkan b. dikristalkan c. dilelehkan d. didisosiasikan e. dibekukan |
|
6. |
Pada senyawa polar terjadi suatu gaya yang dapat memutuskan ikatan sehingga terbentuk ion. Gaya tersebut adalah gaya …. a. magnet b. gravitasi c. potensial d. tolak menolak e. tarik menarik |
|
7. |
Larutan H2SO4 dapat menghantarkan listrik karena …. a. H2SO4 mengalami ionisasi dengan adanya arus listrik b. H2SO4 larut dalam air dengan melepaskan elektron c. H2SO4 dapat larut dalam air d. H2SO4 merupakan senyawa ion e. H2SO4 dalam air terionisasi sebelum dihubungkan dengan baterai |
|
8. |
Kelompok manakah yang merupakan elektrolit dan berikatan ion …. a. N2SO4, KCl, NaOH b. NaCl, KBr, MgCl2 c. CH3COOH, CO(NH2)2 , NaCl d. KCl, MgBr2, H2SO4 e. H2SO4, CO(NH2)2, NaCl |
|
9. |
Dari senyawa berikut terionisasi sempurna dan berikatan kovalen kecuali … a. HCl dan H2SO4 b. HI dan HCl c. H2SO4 dan HI d. H2O dan NaCl e. HNO3 dan H2SO4 |
|
10. |
Senyawa elektrolit kuat yang menghasilkan 2 ion H+ dalam reaksi ionisasinya adalah … a. H2CO3 b. H2S c. HBr d. H2SO4 e. H3PO4 |
B. Jawablah Essay di bawah ini dengan jawaban yang benar!
1. Sebanyak 0,1 mol asam asetat dilarutkan dalam 1 liter air. Jika 0,001 mol asam itu mengion, maka derajat ionisasi (ἀ) nya adalah
Jawab:……………………………………………………………………………………………………………………………………………………………
2. Sebanyak 1.000 molekul HF dilarutkan dalam air, ternyata dalam larutan terdapat 100 mol ion F–. berapakah ionisasi asam HF itu?
Jawab:……………………………………………………………………………………………………………………………………………………………
3. Manakah yang merupakan konduktor yang lebih baik? Jelaskan jawabanmu.
a. H2SO4 0,1 M atau CH3COOH 0,1 M
Jawab:………………………………………………………………………………………………………………………………………………………
b. H2SO4 0,1 M atau H2SO4 0,2 M
Jawab:………………………………………………………………………………………………………………………………………………………
4. Berikut ini pengujian daya hantar berbagai jenis zat
|
Zat murni |
bentuk |
Menghantar |
larutan |
menghantar |
| BromineRaksaZink
Zink Air Asam cuka Kalium klorida Kalium Klorida
|
CairCairPadat
Cair Cair Cair Padat cair |
TidakYaTidak
Ya Tidak Tidak Tidak ya |
Etanol (C2H5OH)Gula (C12H22O11)Asam sulfat (H2SO4)
Asam cuka (CH3COOH) Kalium klorida (KCl) |
TidakTidakYa
Ya ya |
a. diantara zat murni yang diuji, golongan zat apakah yang dapat menghantar listrik?
Jawab:……………………………………………………………………………………………………………………………………………………………
b. di antara seluruh zat yang di uji, manakah yang tergolong senyawa ion dan manakah yang tergolong senyawa kovalen?
Jawab:………………………………………………………………………………………………………………………………………………………
c. Apakah perbedaan antara elektrolit senywa ion dan elektrolit senyawa kovalen?
Jawab:……………………………………………………………………………………………………………………………………………………………
5. Tentukan apakah yang berikut ini dapat atau tidak dapat menghantarkan listrik
a. Logam aluminium
Jawab:…………………………………………………………………………………………………………………………………………………
b. Aluminium cair
Jawab:…………………………………………………………………………………………………………………………………………………
c. Klorin cair
Jawab:…………………………………………………………………………………………………………………………………………………
d. Kristal NaCl
Jawab:…………………………………………………………………………………………………………………………………………………
e. Lelehan NaCl
Jawab:…………………………………………………………………………………………………………………………………………………
f. Larutan NaCl
Jawab:…………………………………………………………………………………………………………………………………………………
g. Lelehan asam asetat murni
Jawab:…………………………………………………………………………………………………………………………………………………
h. Larutan asam asetat
Jawab:…………………………………………………………………………………………………………………………………………………
i. Kristal gula
Jawab:…………………………………………………………………………………………………………………………………………………
j. Larutan gula
Jawab:…………………………………………………………………………………………………………………………………………………
6. Manakah diantara zat berikut yang mungkin tergolong elektrolit?
a. KBr
b. HBr
c. CH4
d. CaO
Jawab:……………………………………………………………………………………………………………………………………………………………
7. Jika diuji dengan alat enguji elektrolit, ternyata larutan NH3 0,1 M merupakan konduktor yang lebih buruk dari pada larutan NaCl 0,1 M. mengapa demikian?
Jawab:……………………………………………………………………………………………………………………………………………………………
8. Uji Daya hantar Listrik Larutan
Tujuan
Menguji daya hantar listrik beberapa larutan serta mengamati gejala berlangsungnya hantaran arus listrik.
Alat dan Bahan
*Alat
Alat uji elektrolit 1 set
Gelas Kimia 8 buah
*Bahan
|
Bahan |
Jumlah |
| Larutan CH3COOH 1M Larutan NH4OH 1M Larutan NaOH 1M Larutan HCl 1M Larutan NaCl 1M Larutan gula 10% Larutan urea 10% Etanol (alkohol) 70 % |
50 mL |
Langkah Kerja
Keterangan :
1. batu baterai
2. kabel penghubung
3. bola lampu
4. elektroda karbon
5. elektroda karbon
6. larutan yang diuji
7. gelas kimia
Cara Kerja :
- Alat uji elektrolit disusun seperti gambar diatas.
- Masukkan setiap larutan sebanyak 50 mL ke dalam gelas kimia.
- Lakukan uji daya hantar listriknya. Jika memungkinkan, sebaiknya percobaan untuk beberapa larutan dilakukan bersamaan sehingga dapat diamati dan dibandingkan gejala hantaran tang terjadi.
- Amati perubahan yang terjadi! Catat sebagai data pengamatan!
Data Pengamatan
|
No |
Bahan Uji |
Bola Lampu |
Gelembung Gas |
Keterangan |
|
1 |
Larutan HCl 1M | |||
|
2 |
Larutan CH3COOH 1M | |||
|
3 |
Larutan NH4OH 1M | |||
|
4 |
Larutan NaOH 1M | |||
|
5 |
Larutan NaCl 1M | |||
|
6 |
Larutan gula 10% | |||
|
7 |
Larutan urea 10% | |||
|
8 |
Etanol (alkohol) 70% |
Pertanyaan
a) Berdasarkan pengamatan Anda, sebutkan gejala berlangsungnya hantaran arus listrik!
Jawab:………………………………………………………………………………………………………………………………………………………
b) Kelompokkan bahan uji tersebut ke dalam larutan yang dapat menghantarkan arus listrik (larutan elektrolit) dan larutan yang tidak dapat menghantarkan arus listrik (larutan non elektrolit)!
Jawab:………………………………………………………………………………………………………………………………………………………
KONSEP REAKSI REDOKS
Redoks (singkatan dari reaksi reduksi/oksidasi) adalah istilah yang menjelaskan berubahnya bilangan oksidasi (keadaan oksidasi) atom-atom dalam sebuah reaksi kimia.
Hal ini dapat berupa proses redoks yang sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida, atau reduksi karbon oleh hidrogen menghasilkan metana(CH4), ataupun ia dapat berupa proses yang kompleks seperti oksidasi gula pada tubuh manusia melalui rentetan transfer elektron yang rumit.
Istilah redoks berasal dari dua konsep, yaitu reduksi dan oksidasi. Ia dapat dijelaskan dengan mudah sebagai berikut:
- Reduksi menjelaskan pelepasan elektron oleh sebuah molekul, atom, atau ion
- Oksidasi menjelaskan penambahan elektron oleh sebuah molekul, atom, atau ion.
Walaupun cukup tepat untuk digunakan dalam berbagai tujuan, penjelasan di atas tidaklah persis benar. Oksidasi dan reduksi tepatnya merujuk pada perubahan bilangan oksidasi karena transfer elektron yang sebenarnya tidak akan selalu terjadi. Sehingga oksidasi lebih baik didefinisikan sebagai peningkatan bilangan oksidasi, dan reduksi sebagai penurunan bilangan oksidasi. Dalam prakteknya, transfer elektron akan selalu mengubah bilangan oksidasi, namun terdapat banyak reaksi yang diklasifikasikan sebagai “redoks” walaupun tidak ada transfer elektron dalam reaksi tersebut (misalnya yang melibatkan ikatan kovalen). Reaksi non-redoks yang tidak melibatkan perubahan muatan formal (formal charge) dikenal sebagai reaksi metatesis.
A. Konsep Reaksi Oksidasi-Reduksi (Redoks)
Jika sepotong besi diletakkan di udara terbuka, ternyata lama-kelamaan logam besi tersebut berkarat. Mengapa logam besi dapat berkarat dan reaksi apa yang terjadi pada logam besi tersebut? Peristiwa perkaratan besi merupakan salah satu contoh dari reaksi reduksi-oksidasi (redoks). Lalu apa yang dimaksud dengan reaksi redoks?
B. Perkembangan Konsep Reaksi Reduksi-Oksidasi
Pengertian konsep reaksi reduksi-oksidasi telah mengalami tiga tahap perkembangan sebagai berikut:
1. Berdasarkan Pengikatan dan Pelepasan Oksigen
a. Reduksi adalah reaksi pelepasan oksigen dari suatu senyawa.
Reduktor adalah:
1) Zat yang menarik oksigen pada reaksi reduksi.
2) Zat yang mengalami reaksi oksidasi.
Contoh:
1) Reduksi Fe2O3 oleh CO
Fe2O3 + 3 CO→ 2 Fe + 3 CO2
2) Reduksi Cr2O3 oleh Al
Cr2O3 + 2 Al → 2 Cr + Al2O3
b. Oksidasi adalah reaksi pengikatan (penggabungan) oksigen oleh suatu zat.
Oksidator adalah:
1) Sumber oksigen pada reaksi oksidasi.
2) Zat yang mengalami reduksi.
Contoh:
1) Oksidasi Fe oleh O2
4 Fe + 3 O2 → 2 Fe2O3
2) Pemangggangan ZnS
2 ZnS + 3 O2 → 2 ZnO + 2 SO2
2. Berdasarkan Pengikatan dan Pelepasan Elektron
a. Reduksi adalah reaksi pengikatan elektron.
Reduktor adalah:
1) Zat yang melepaskan elektron.
2) Zat yang mengalami oksidasi.
Contoh:
1) Cl2 + 2 e– → 2 Cl–
2) Ca2+ + 2 e– → Ca
b. Oksidasi adalah reaksi pelepasan elektron.
Oksidator adalah:
1) Zat yang mengikat elektron.
2) Zat yang mengalami reduksi.
Contoh:
1) K → K+ + e–
2) Cu→ Cu2+ + 2 e–
3. Berdasarkan Pertambahan dan Penurunan Bilangan Oksidasi
a. Reduksi adalah reaksi penurunan bilangan oksidasi.
Reduktor adalah:
1) Zat yang mereduksi zat lain dalam reaksi redoks.
2) Zat yang mengalami oksidasi.
Contoh:
2 SO3 → 2 SO2 + O2
Bilangan oksidasi S dalam SO3 adalah +6 sedangkan pada SO2 adalah +4. Karena unsur S mengalami penurunan bilangan oksidasi, yaitu dari +6 menjadi +4, maka SO3 mengalami reaksi reduksi. Oksidatornya adalah SO3 dan zat hasil reduksi adalah SO2.
b. Oksidasi adalah reaksi pertambahan bilangan oksidasi.
Oksidator adalah:
1) Zat yang mengoksidasi zat lain dalam reaksi redoks.
2) Zat yang mengalami reaksi reduksi.
Contoh:
4 FeO + O2 → 2 Fe2O3
Bilangan oksidasi Fe dalam FeO adalah +2, sedangkan dalam Fe2O3 adalah +3. Karena unsur Fe mengalami kenaikan bilangan oksidasi, yaitu dari +2 menjadi +3, maka FeO mengalami reaksi oksidasi. Reduktornya adalah FeO dan zat hasil oksidasi adalah Fe2O3. Jika suatu reaksi kimia mengalami reaksi reduksi dan oksidasi sekaligus dalam satu reaksi, maka reaksi tersebut disebut reaksi reduksi-oksidasi atau reaksi redoks. Contoh:
a. 4 FeO + O2 ⎯⎯→ 2 Fe2O3 (bukan reaksi redoks)
b. Fe2O3 + 3 CO ⎯⎯→ 2 Fe + 3 CO2 (reaksi reduksi oksidasi)
Dua bagian dalam sebuah reaksi redoks
Gambar 2.1 : Besi Berkarat
Gambar 2.2 : Pembakaran terdiri dari reaksi redoks yang melibatkan radikal bebas
|
Reaksi Redoks
Tujuan : mengamati contoh reaksi oksidasi dan reduksi
Cara Kerja :
- Amplaslah pita magnesium hingga pita bbersih. Kemudian, jepit pita magnesium dengan tang besi, lalu bakar. Tamping abu hasil pembakaran dalam tabung reaksi. (perhatikan jangan menatap pita magnesium yang sedang terbakar)
- Campurkan serbuk tembaga (II) oksida dan serbuk karbon, masing-masing kira-kira 5 gram, dalam tabung reaksi. Kemudian panaskan camuran itu hingga terbentuk logam tembaga. Pemanasan sebaiknya menggunakan pembakar Bunsen.
Analisis Data/ pertanyaan :
- Zat yang terbentuk pada pembakaran magnesium di udara terdiri dari atas MgO dan Mg3N2.
- Nyatakan apakah reaksi pembakaran magnesium termasuk oksidasi atau reduksi tersebut
- Reaksi antara serbuk tembaga (II) oksidaso dengan serbuk karbon menghasilkan tembaga dan karbon monoksida (CO). tuliskan persamaan setara untuk reaksi tersebut
- Nyatakan apakah reaksi antara serbuk tembaga (II) oksidasi dengan serbuk karbon tergolong reduksi/ oksidasi? Jelaskan Jawabanmu
- Apa yang terjadi pada karbon prosedur (2) di atas?
- Apakah sudah tepat jika reaksi antara serbuk tembaga (II) oksida dengan serbuk karbon disebut sebagai reaksi reduksi? Jika tidak, apa nama yang sebaiknya digunakan untuk reaksi tersebut?
- Apakah fungsi karbon pada reaksi antara serbuk tembaga (II) oksida dengan serbuk karbon? Zat mana yang berfungsi sebagai pengoksidasi dalam reaksi itu?
- Tariklah kesimpulan dari percobaan ini
Jawab:………………………………………………………………
C. Bilangan Oksidasi
1. Tata Nama Senyawa Berdasarkan Bilangan Oksidasi
Pada semester I telah kita pelajari tata nama senyawa, sekarang akan kitapelajari tata nama senyawa alternatif menurut IUPAC berdasarkan bilanganoksidasi.
Perhatikan tabel berikut ini!
|
Rumus Kimia |
Nama |
Nama Alternatif Berdasarkan Biloks |
| N2O | Dinitrogen monoksida | Nitrogen(I) oksida |
| N2O3 | Dinitrogen trioksida | Nitrogen(III) oksida |
| HClO | Asam hipoklorit | Asam klorat(I) |
| HClO2 | Asam klorit | Asam klorat(III) |
| HClO3 | Asam klorat | Asam klorat(V) |
| HClO4 | Asam perklorat | Asam klorat(VII) |
Bilangan oksidasi adalah suatu bilangan yang menunjukkan ukuran kemampuan suatu atom untuk melepas atau menangkap elektron dalam pembentukan suatu senyawa. Nilai bilangan oksidasi menunjukkan banyaknya elektron yang dilepas atau ditangkap, sehingga bilangan oksidasi dapat bertanda positif maupun negatif.
2. Penentuan Bilangan Oksidasi Suatu Unsur
Kita dapat menentukan besarnya bilangan oksidasi suatu unsur dalam senyawa dengan mengikuti aturan berikut ini (James E. Brady, 1999). Aturan penentuan bilangan oksidasi unsur adalah:
a. Unsur bebas (misalnya H2, O2, N2, Fe, dan Cu) mempunyai bilangan oksidasi = 0.
b. Umumnya unsur H mempunyai bilangan oksidasi = +1, kecuali dalam senyawa hidrida, bilangan oksidasi H = –1.
Contoh:
- Bilangan oksidasi H dalam H2O, HCl, dan NH3 adalah +1
- Bilangan oksidasi H dalam LiH, NaH, dan CaH2 adalah –1
c. Umumnya unsur O mempunyai bilangan oksidasi = –2, kecuali dalam senyawa peroksida, bilangan oksidasi O = –1
Contoh:
- Bilangan oksidasi O dalam H2O, CaO, dan Na2O adalah –2
- Bilangan oksidasi O dalam H2O2, Na2O2 adalah –1
d. Unsur F selalu mempunyai bilangan oksidasi = –1.
e. Unsur logam mempunyai bilangan oksidasi selalu bertanda positif.
Contoh:
- Golongan IA (logam alkali: Li, Na, K, Rb, dan Cs) bilangan oksidasinya = +1
- Golongan IIA (alkali tanah: Be, Mg, Ca, Sr, dan Ba) bilangan oksidasinya = +2
f. Bilangan oksidasi ion tunggal = muatannya.
Contoh: Bilangan oksidasi Fe dalam ion Fe2+ adalah +2
g. Jumlah bilangan oksidasi unsur-unsur dalam senyawa = 0.
Contoh:
- Dalam senyawa H2CO3 berlaku: 2 biloks H + 1 biloks C + 3 biloks O = 0
h. Jumlah bilangan oksidasi unsur-unsur dalam ion poliatom = muatan ion.
Contoh:
- Dalam ion NH4+ berlaku 1 biloks N + 4 biloks H = + 1
Contoh reaksi redoks
Salah satu contoh reaksi redoks adalah antara hidrogen dan fluorin:
Kita dapat menulis keseluruhan reaksi ini sebagai dua reaksi setengah: reaksi oksidasi
dan reaksi reduksi
Penganalisaan masing-masing reaksi setengah akan menjadikan keseluruhan proses kimia lebih jelas. Karena tidak terdapat perbuahan total muatan selama reaksi redoks, jumlah elektron yang berlebihan pada reaksi oksidasi haruslah sama dengan jumlah yang dikonsumsi pada reaksi reduksi.
Unsur-unsur, bahkan dalam bentuk molekul, sering kali memiliki bilangan oksidasi nol. Pada reaksi di atas, hidrogen teroksidasi dari bilangan oksidasi 0 menjadi +1, sedangkan fluorin tereduksi dari bilangan oksidasi 0 menjadi -1.
Ketika reaksi oksidasi dan reduksi digabungkan, elektron-elektron yang terlibat akan saling mengurangi:
Dan ion-ion akan bergabung membentuk hidrogen fluorida:
3. Reaksi penggantian
Redoks terjadi pada reaksi penggantian tunggal atau reaksi substitusi. Komponen redoks dalam tipe reaksi ini ada pada perubahan keadaan oksidasi (muatan) pada atom-atom tertentu, dan bukanlah pada pergantian atom dalam senyawa.
Sebagai contoh, reaksi antara larutan besi dan tembaga(II) sulfat:
Persamaan ion dari reaksi ini adalah:
Terlihat bahwa besi teroksidasi:
dan tembaga tereduksi:
Contoh-contoh lainnya :
- Besi(II) teroksidasi menjadi besi(III)
- hidrogen peroksida tereduksi menjadi hidroksida dengan keberadaan sebuah asam:
H2O2 + 2 e− → 2 OH−
Persamaan keseluruhan reaksi di atas adalah:
2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2H2O
- denitrifikasi, nitrat tereduksi menjadi nitrogen dengan keberadaan asam:
2NO3− + 10e− + 12 H+ → N2 + 6H2O
- Besi akan teroksidasi menjadi besi(III) oksida dan oksigen akan tereduksi membentuk besi(III) oksida (umumnya dikenal sebagai perkaratan):
4Fe + 3O2 → 2 Fe2O3
- Pembakaran hidrokarbon, contohnya pada mesin pembakaran dalam, menghasilkan air, karbon dioksida, sebagian kecil karbon monoksida, dan energi panas. Oksidasi penuh bahan-bahan yang mengandung karbon akan menghasilkan karbon dioksida.
- Dalam kimia organik, oksidasi seselangkah (stepwise oxidation) hidrokarbon menghasilkan air, dan berturut-turut alkohol, aldehida atau keton, asam karboksilat, dan kemudian peroksida.
contoh soal perhitungan bilangan oksidasi
|
SOAL PENYETARAAN PERSAMAAN REAKSI REDOKS
- Tentukan biloks unsur Cl dalam :
a) Cl-
b) Cl2
c) HCl
d) HClO2
e) HClO4
f) Ca(OCl)2
Jawab:…………………………………………………………………………
- Tentukan biloks unsur Mn dalam :
a) MnO2
b) Mn2O3
c) KMnO4
Jawab:…………………………
- Setarakan reaksi redoks berikut : MnO4– +ClO2– à MnO2 + ClO4–
Jawab:……………………………………………
4. Penerapan Konsep Reaksi Redoks dalam Pengolahan Limbah (Lumpur Aktif)
Salah satu penerapan konsep reaksi redoks dalam kehidupan sehari-hariadalah dalam bidang pengolahan limbah. Prinsip dasar yang dipergunakanadalah teroksidasinya bahan-bahan organik maupun anorganik, sehingga lebihmudah diolah lebih lanjut.Limbah merupakan salah satu pencemar lingkungan yang perlu dipikirkancara-cara mengatasinya. Untuk menjaga dan mencegah lingkungan tercemarakibat akumulasi limbah yang semakin banyak, berbagai upaya telah banyakdilakukan untuk memperoleh teknik yang tepat dan efisien sesuai kondisi lokal.Berbagai tipe penanganan limbah cair dengan melibatkan mikroorganismetelah dikerjakan di Indonesia, yaitu sedimentasi, kolam oksidasi, trickling filter, lumpur aktif (activated sludge), dan septic tank. Pada uraian ini akan kita pelajari salah satu teknik saja, yaitu teknik lumpur aktif (activated sludge).
Proses lumpur aktif (activated sludge) merupakan sistem yang banyakdipakai untuk penanganan limbah cair secara aerobik. Lumpur aktif merupakanmetode yang paling efektif untuk menyingkirkan bahan-bahan tersuspensimaupun terlarut dari air limbah. Lumpur aktif mengandung mikroorganismeaerobik yang dapat mencerna limbah mentah. Setelah limbah cair didiamkandi dalam tangki sedimentasi, limbah dialirkan ke tangki aerasi. Di dalam tangkiaerasi, bakteri heterotrofik berkembang dengan pesatnya. Bakteri tersebutdiaktifkan dengan adanya aliran udara (oksigen) untuk melakukan oksidasibahan-bahan organik. Bakteri yang aktif dalam tangki aerasi adalah Escherichiacoli, Enterobacter, Sphaerotilus natans, Beggatoa, Achromobacter, Flavobacterium,dan Pseudomonas. Bakter-bakteri tersebut membentuk gumpalan-gumpalan atau flocs. Gumpalan tersebut melayang yang kemudianmengapung di permukaaan limbah.
|
A. Jawablah pertanyaan-pertanyaan di bawah ini dengan jawaban yang benar dan tepat !
- Dalam reaksi MnO4– (aq) + C2O42-(aq) → Mn2+(aq) + CO2(g) suasana asam, persamaan :
C2O42- → CO2 melepaskan elektron sebanyak ….
A.1 D. 4
B.2 E. 5
C.3
- Reaksi MnO4–(aq) + C2O42-(aq) → Mn2+(aq) + CO2(g) berlangsung dalam suasana asam; setiap mol MnO4– memerlukan H+ sebanyak ….
A.4 mol D. 10 mol
B.6 mol E. 12 mol
C.8 mol
- Pernyataan yang benar untuk reaksi : MnO4– (aq) + C2O42- (aq) → Mn2+ (aq) + CO2(g) yang berlangsung dalam suasana asam adalah ….
A.membutuhkan 14 elektron untuk menyetarakan reaksi
B.membutuhkan 4 H2O di ruas kiri
C.menghasilkan 10 mol gas CO2
D.setiap mol C2O42- menghasilkan 5 mol CO2
E.setiap mol MnO4– menghasilkan 2 mol Mn2+
- Jika MnO4→MnO2 berlangsung dalam suasana basa, jumlah elektron yang terlibat adalah ….
A.3 D. 6
B.4 E. 7
C.5
- Pada penyetaraan reaksi MnO4–→MnO2 dalam suasana basa, setiap mol MnO4- melepaskan ion OH- sebanyak ….
A.2 mol D. 8 mol
B.4 mol E. 10 mol
C.6 mol
- Pada reaksi :
aCr2O7–(aq) + 14H+ (aq) + bFe2+ (aq) →cCr3+(aq) + 7H2O (l) + dFe3+(aq)
Nilai a, b, c, dan d berturut-turut dalam reaksi setara adalah ….
A.1, 4, 2, 4 D. 2, 8, 4, 8
B.1, 6, 2, 6 E. 3, 8, 6, 8
C.2, 8, 2, 8
- Aluminium dalam ion nitrat membentuk ion AIO2– dan gas NH3. Jika reaksi berlangsung dalam suasana basa, reaksi Al →AIO2– melepaskan elektron sebanyak .…
A.2 D. 5
B.3 E. 6
C.4
- Reaksi : Al(s) + NO3(aq) → AIO2(aq) + NH3(g) berlangsung dalam suasana basa. Setiap 4 mol aluminium dihasilkan gas NH3 (STP) sebanyak ….
A.11,2 liter D. 44,8 liter
B.22,4 liter E. 56 liter
C.33,6 liter
- Reaksi : Cr2O7(aq) + SO2(g) →Cr3+ (aq) + HSO4– (aq) berlangsung dalam suasana asam. Penyetaraan terhadap setengah reaksi : SO2 →HSO4 menghasilkan ….
A.SO2 + 2H2O → HSO4– + 3H+ + 2e
B.SO2 + H2O → HSO4– + 2H+ + e
C.SO2 + H3O+ → HSO4– + 3H+ + 2e
D.SO2 + H+ → HSO4– + 3H2O + e
E.SO2 + 2H+ → HSO4- + 3H3O+ + 2e
- Gas khlor dalam suasana basa dapat mengalami disproporsionasi menjadi ion khlorida dan ion khlorat. Persamaan reaksi setara yang benar adalah ….
A.Cl2 + 2OH → Cl– + ClO3– + H2O
B.2Cl2 + 4OH → 2Cl– + ClO3– +2 H2O
C.3Cl2 + 6OH →5Cl– + ClO3– + 3H2O
D.4Cl2 + 2OH →5Cl– + 2ClO3– + 2H2O
E.5Cl2 + 8OH →6Cl– + 4ClO3– + 4H2O
- Pada reaksi redoks berikut :
KMnO4 (aq) + K2C2O3 (aq) + H2SO4 (aq) → K2SO4 (aq) + MnSO4 (aq) + CO2 (g) + H2O (l).
Setengah reaksi oksidasi dari reaksi di atas adalah ….
A.MnO4– (aq) + 8H+ (aq) + 5e → Mn2+(aq) + 4H2O (l)
B.Mn2+ (aq) →Mn7+(aq) + 2e
C.C2O42- (aq) → CO2(g) + 2e
D.4H+ (aq) + O2(g) + 4e → 2H2O (l)
E.H2C2O4 (aq) + 2H+ (aq) + 2e → CO2(g) + 2H2O (l)
- Diberikan 2 buah setengah reaksi :
MnO4–(aq) + 8H+(aq) + 5e → Mn2+(aq) + 4H2O(l)
SO32-(aq) + H2O (l) → SO42-(aq) + 2H+ + 2e.
Pada penyetaraan reaksi redoks yang melibatkan MnO4- dalam suasana asam, perbandingan mol MnO4– dengan SO32- adalah ….
A.1 : 2 D. 2 : 5
B.1 : 5 E. 5 : 2
C.2 : 1
- Reaksi reduksi di bawah ini yang membutuhkan 2 elektron adalah ….
A.SO42-→SO2 D. CIO3 → CI
B.I2 → 2I E. S2O32 → S
C.NO3 → NO
- Perhatikan spesi khlor berikut :
1.Cl–
2. CIO3–
3.CIO–
4. CIO4–
5.CIO2–
Khlor yang tidak dapat direduksi adalah …..
A.1
B.2
C.3
D.4
E.5
- Diketahui persamaan reaksi :
Cr2O72-(aq)+14H+(aq) + 6e → 2Cr3+(aq) + 7H2O(l)
Mn2+(aq) + 4H2O(l) → MnO4(aq) + 8H+(aq) + 5e
Ion Mn2+ yang diperlukan untuk mereduksi 1 mol Cr2O72- sebanyak ….
A.0,4 mol D. 1,2 mol
B.0,6 mol E. 1,5 mol
C.0,8 mol
- Jika reaksi redoks MnO4(aq) + Br(aq) → Mn2+(aq) + Br2(g) disetarakan dengan perubahan bilangan oksidasi, setelah sampai pada tahapan 2MnO4–(aq) + 10 Br –(aq) →Mn2+ (aq) + 5 Br2(g) langkah berikutnya adalah ….
A.ruas kiri + 4 H2O D. Ruas kanan + 8H+
B.ruas kiri + 8 H2O E. Ruas kanan + 4H+
C.ruas kiri + 16 H+
- Diketahui 26 mL larutan 0,1 M suatu ion logam, tepat bereaksi dengan 25 mL larutan 0,1 M senyawa arsenat menurut persamaan :
AsO33-(aq) + H2O(l) →AsO43-(aq) + 2H+(aq) + 2e. Jika bilangan oksidasi logam sebelah kanan +4, maka bilangan oksidasi setelah reaksi ….
A.0 D. +3
B.+1 E. +4
C.+2
- Penyetaran reaksi redoks Cl2(g) + 4IO3–(aq) → 2Cl–(aq) +3 IO4–(aq), perbandingan mol Cl2 : IO3- adalah ….
A.1 : 1 D. 2 : 1
B.1 : 2 E. 2 : 2
C.1 : 3
- Dari reaksi di bawah ini yang termasuk reaksi otoredoks adalah ….
A.KMnO4(aq) + K2C2O4(aq) + H2SO4(aq) → K2SO4(aq) + MnSO4(aq) + CO2(g) + H2O (l)
B.K2S2O3 (aq) + HBr(aq) →S(s) + SO2(g) + KBr(aq) + H2O (l)
C.FeS(aq) + HNO3(aq) → Fe(NO3)3 (aq) + S(s) + NO2 (g) + H2O (l)
D.CaO(s) + CO2(g) →CaCO3(s)
E.CH4(g) + O2(g) →CO2(g) + H2O(l)
- Pada reaksi redoks :
H2O2(aq) + Cr(OH)4–(aq) →CrO4-(aq)
Oksigen dalam setengah reaksi : H2O2 →CrO42- berubah bilangan oksidasi dari…. dan menjadi…
A.–2 → -2 D. +1 →-2
B.-1→-2 E. +2 → -2
C.0 → -2
|
Pilihan Ganda
Pilihlah salah satu jawaban yang benar
- 1. Diketahui data percobaan daya hantar Listrik air dari berbagai sumber sebagai berikut:
|
No |
Jenis Air |
Nyala lampu |
Pengamatan Lain |
|
1 |
Air Laut |
Redup |
Ada Gas |
|
2 |
Air Ledeng |
– |
Ada Gas |
|
3 |
Air Danau |
– |
Ada Gas |
|
4 |
Air Sumur |
Redup |
Ada Gas |
|
5 |
Air Sungai |
– |
Ada Gas |
Dari data tersebut dapat disimpulkan bahwa…….
- Air laut merupakan elektrolit
- Air sungai bersifat nonelektrolit
- Ada air yang bersifat elektrolit dan nonelektrolit
- Semua air dari berbagai sumber bersifat elektrolit
- Sifat elektrolit air bergantung pada jenis zat pelarut
- Di antara bahan berrikut:
- Gula 4. Urea
- Garam 5. Pemutih
- Cuka
Yang larutannya dalam air dapat menghantar listrik adalah
a. 1,2, dan 3 D. 1,4, dan 5
b. 1,3, dan 5 E. 2,3,dan 4
c. 2,3, dan 5
- Suatu zat padat dilarutkan ke dalam air, dan ternyata larutan zat itu dapat menghantar arus listrik. Pernyataan yang tepat untuk menerangkan peristiwa ini adalah..
a. Dalam air, zat padat itu terurai menjadi ionnya
b. Dalam air, zat padai itu terurai menjadi atomnya
c. Dalam air, zat padat itu terurai menjadi molekulnya
d. Air menjadi mudah terionisasi bila ada zat padat di dalamnya
e. Air menjadi konduktor listrik bila ada zat terlarut di dalamnya
- Berikut ini hasil percobaan daya hantar listrik dan beberapa larutan
|
Zat |
Lampu |
Pengamatan Lain |
|
1 |
Nyala Terang |
Banyak Gelembung |
|
2 |
Nyala Redup |
Banyak Gelembung |
|
3 |
Tidak Menyala |
Sedikit Gelembung |
|
4 |
Tidak Menyala |
Tidak Ada Gelembung |
Dari data di atas, pasangan yang di golongkan elektrolit kuat dan elektrolit lemah berturut-turut adalah..
a. 1 dan 2 D. 2 dan 4
b. 1 dan 3 E. 3 dan 4
c. 1 dan 4
HUKUM-HUKUM DASAR KIMIA
| I.Standar Kompetensi: 2.Memahami hukum-hukum dasar kimia
II.Kompetensi Dasar :2.1Membuktikan dan mengkomunikasikan berlakunya hokum-hukum dasar kimia melalui percobaan
|
SUB MATERI POKOK 1 .Hukum Lavoisier (Hukum Kekekalan Massa)
Hukum Kekekalam Massa pertama kali dikemukakan oleh Lavoisier (1743-1794) dimana :
| Bunyi Hukum Kekekalan Massa (Hukum Lavoisier)
“ Massa zat sebelum dan sesudah reaksi adalah sama”
|
Contoh:
1.Jika kayu dibakar dengan gas oksigen,akan dihasilkan arang dan gas.Massa total kayu dan gas oksigen akan sama dengan massa total arang dan gas (asap).
2.12 gram karbon bereaksi dengan 32 gram gas oksigen akan menghasilkan 44 gram karbondioksida.
C + O2 CO2
12 gram 32 gram 44 gram
Massa sebelum reaksi = 12 + 32 = 44 gram
Massa sesudah reaksi = 44 gram
|
Tagihan
|
A.Jawablah pertanyaan-pertanyaan di bawah ini dengan tepat dan jelas!
1.Terangkan bunyi Hukum Kekekalan Massa !
Jawab:……………………………………………………………………………………………………………………………………………………………………………
2.Jika 7 gram besi dibiarkan berbulan-bulan di udara terbuka,lama-kelamaan besi itu berkarat dan massanya bertambah menjadi 10 gram.Apakah di sini berlaku Hukum Kekekalan Massa : Jelaskan jawabanmu !
Jawab:……………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
3.Jelaskan mengapa abu hasil pembakaran kertas lebih kecil daripada massa kertas yang dibakar ?
Jawab:…………………………………………………………………………………………………………………………………………………………………………….
B.Tugas
Terjadinya suatu reaksi kimia ditunjukkan oleh perubahan zat baru.Apakah perbandingan ini juga perubahan massa?
Untuk menjawab pertanyaan ini lakukan percobaan berikut ini!
Alat dan Bahan :
1.Labu 5.Larutan NaOH
2.Sumbang karet 6. Larutan CuSO4
3.Tabung reaksi kecil 7.Larutan KI
4.Neraca 8.Larutan Pb(NO3)2
Cara kerja:
1.Masukkan 10 ml larutan NaOH ke dalam labu Erlenmeyer dan 5 ml larutan CuSO4 ke dalam tabung reaksi kecil.Masukkan tabung itu ke dalam Erlenmeyer dan sumbat labu itu
2.Timbang labu Erlenmeyer dengan isinya dan catat massanya.
3.Miringkan labu sehingga kedua larutan dapat bercampur.Perubahan apakah yang terjadi ?
4.Timbang labu labu Erlenmeyer dengan isinya dan catat massanya.
5.Lakukan percobaan yang sama dengan menggunakan 10 ml larutan KI dan 5 ml larutan Pb(NO3)2
SUB MATERI POKOK 2.HUKUM PROUST (HUKUM PERBANDINGAN TETAP)
Dalam suatu percobaan antara hidrogen dan oksigen menghasilkan air diperoleh data sebagai berikut :
|
No |
Massa hidrogen yang dihasilkan |
Massa oksigen yang direaksikan |
Massa air yang terbentuk |
Massa pereaksi yang sisa |
|
1. 2. 3. 4. 5 |
1 gram 2 gram 1 gram 2 gram 5 gram |
8 gram 16 gram 9 gram 8 gram 24 gram |
9 gram 18 gram 9 gram 9 gram 27 gram |
– – 1 gram oksigen 1 gram oksigen 2 gram oksigen |
Berdasarkan data diatas dapat disimpulkan bahwa perbandingan massa suatu unsur dalam membentuk senyawa adalah sama/tetap,yaitu perbandingan massa hidrogen dan oksigen dalam membentuk senyawa air adalah 1 : 8.Percobaan ini dikemukakan oleh seorang ahli kimia Joseph Louis Proust (1754-1826) dapat disimpulkan:
| Bunyi Hukum Proust menyatakan :
“Perbandingan massa unsur-unsur yang menyusun senyawa selalu tetap
|
Misal: air terbentuk dari unsur hidrogen dan oksigen dengan perbandingan 1 : 8
Jika hidrogen yang digunakan = 2 gram
Maka oksigen tepat bereaksi = x 2 = 16 gram
Air yang terbentuk = 18 gram
Contoh soal:
a.Untuk membentuk air tersedia 5 gram hidrogen.
Berapa gram oksigen yang harus tersedia supaya tepat bereaksi membentuk air ?
Jawab:
Air mempunyai perbandingan hidrogen : oksigen = 1 : 8
hidrogen = 5 gram
oksigen = x 5 = 40 gram
air yang terbentuk = 45 gram
b.Untuk membentuk karbondioksida diperlukan karbon dan oksigen dengan perbandingan
3 : 8.Karbon yang tersedia 15 gram dan oksigen 32 gram.Tentukan karbondioksida yang terjadi sebanyak-banyaknya dan unsur yang tersedia!
Jawab :
Karbon : Oksigen = 3 : 8
Misal : Karbon bereaksi semua = 15 gram
Oksigen yang diperlukan = x 15 = 40 gram (tidak mugkin karena oksigen tersedia 32 gram
Misal : Oksigen bereaksi semua = 32 gram
Karbon yang diperlukan = x 32 = 12 gram (mungkin)
Karbondioksida yang terbentuk = 44 gram
|
Tagihan |
B.Tugas
Hubungan antara massa unsure-unsur dalam senyawa
Tujuan:
Menyelidiki hubungan tertentu antara massa tembaga dan massa belerang yang bereaksi membentuk senyawa tembaga sulfida.
Cara kerja:
1.Masukkan 1 spatula belerang dan satu lempeng tembaga (6 cm x 0,8 cm)ke dalam tabung reaksi kering secara terpisah
2.Panaskan lempengan tembaga,kemudian tegakkan tabung reaksi sehingga lempeng tembaga jatuh ke serbuk belerang.
3.Lanjutkan pemanasa sampai tembaga berpijar dan belerang habis bereaksi.
4.Ukur panjang tembaga yag bereaksi dan hitunglah panjang tembaga yang bereaksi.
5.Ulangi percobaan di atas dengan menggunakan serbuk belerang sebanyak 2,3,4,dan 5 kali jumlah semula.
Hasil Pengamatan
| Jumlah takaranbelerang | 1 | 2 | 3 | 4 | 5 |
| Panjang tembaga mula-mula (mm) | |||||
| Panjang tembaga sisa (mm) | |||||
| Panjang tembaga yang bereaksi |
Buatlah grafik panjang tembaga yang bereaksi terhadap jumlah belerang yang digunakan!
| Panjang Tembaga yang bereaksi (mm) | |||||||||||||
A.Jawablah pertanyaan-pertanyaan di bawah ini dengan tepat dan jelas!
1.Bagaimana hubungan antara panjang lempeng tembaga yang bereaksi dengan jumlah belerang yang digunakan ?
Jawab:…………………………………………………………………………………………………………………………………………………………………………….
2.Berapa panjang lempeng tembaga yang akan bereaksi jika belerang yang digunakansebanyak 6 kali jumlah semua ?
Jawab:……………………………………………………………………………………………………………………………………………………………………………
3.Bagaimana hubungan antara massa tembaga dan massa belerang yang bereaksi?
Jawab:……………………………………………………………………………………………………………………………………………………………………………
Catatan :
Dalam percobaan ini massa lempeng tembaga dianggap sebanding dengan panjangnya dan setiap takaran belerang mempunyai massa yang sama.
SUB MATERI POKOK 3 :HUKUM DALTON (HUKUM PERBANDINGAN BERGANDA)
| Bunyi Hukum Perbandingan Berganda (Hukum Dalton):
“Jika dua buah unsur dapat membentuk dua senyawa atau lebih maka perbandingan massa salah satu unsurnya dalam senyawa-senyawa tersebut yang bersenyawa dengan unsur lain yang sama banyaknya merupakan bilangan-bilangan yang bulat dan sederhana”. |
Contoh soal:
Belerang (S) dan oksigen (O) bersenyawa membentuk 2 macam senyawa yaitu : senyawa I terdiri dari
S = 32 g dan O = 32 g.Senyawa II terdiri dari S = 32 g dan O = 48 g.
Buktikan hukum perbandingan berganda berlaku !
Jawab :
Senyawa I S : O = 32 : 32
Senyawa II S : O = 32 : 48
Untuk S yang sama (32) maka berlaku :
OI : OII = 32 : 48 = 2 : 3 (terbukti )
Jadi,kemungkinan senyawa yang terbentuk adalah SO2 dan SO3.
SUB MATERI POKOK 4. HUKUM GAY LUSSAC (HUKUM PERBANDINGAN VOLUM)
Seorang ahli kimia bangsa Prancis Gay Lussac berhasil melakukan percobaan tentang volume gas pada berbagai reaksi.
Misalnya :
- Pada pembentukkan air:
2 volume hidrogen + 1 volume oksigen 2 volume air
2 L gas H2 + 1 L gas O2 2 L air
Maka perbandingan H2 : O2 : H2O = 2 : 1 : 2
- Pada pembentukkan hidrogen klorida
1 L gas H2 + 1 L gas Cl2 2 L gas HCl
Maka perbandingan H2 : Cl2 : HCl = 1 : 1 : 2
Berdasarkan kedua percobaan itu,Gay Lussac mengemukakan hukum perbandingan volume yang berbunyi :
| Bunyi Hukum Gay Lussac ( Hukum Perbandingan Volume)
Volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi,jika diukur pada suhu dan tekanan yang sama akan berbanding sebagai bilangan bulat dan sederhana
|
Perbandingan volume dari hokum Gay Lussac ini sama dengan perbandingan pada koefisien reaksi.
Misal:
Gas hidrogen direaksikan dengan oksigen membentuk air
2 H2(g) + O2(g) 2 H2O(l)
Koefisien reaksi = 2 1 2
Perbandingan volume = 2 : 1 : 2
Contoh soal:
a.Pada suhu dan tekanan tertentu 10 L gas hidrogen direaksikan dengan gas oksigen menghasilkan air.Berapa liter gas oksigen yang harus tersedia dan berapa liter air yang terjadi ?
Jawab : Reaksi : H2(g) + O2(g) H2O(l)
Disetarakan : 2H2(g) + O2(g) 2H2O(l)
Koefisien : 2 : 1 2
: 10 L : 5 L 10 L
Jadi, O2 yang tersedia = 5 L
H2O yang tersedia = 10 L
b.Pada suhu dan tekanan tertentu 10 L gas X (NxHy) dipanaskan sehingga terurai menjadi 5 L gas nitrogen dan 15 L gas hidrogen.Tentukan rumus molekul gas X tersebut !
Jawab : Reaksi : 2 NxHy N2 + 3 H2
Perbandingan volume : 10 5 15
2 : 1 : 3
Persamaan menjadi :
2 NxHy N2 + 3 H2
N : 2x = 2 maka x = 1 Rumus NH3
H : 2y = 6 maka y = 3
SUB MATERI POKOK 5.HUKUM AVOGADRO
Pada tahun 1811 Armadeo Avogadro mengemukakan suatu hipotesis dan akhirnya hipotesis Avogadro telah diakui sebagai hukum.
| Bunyi Hukum Avogadro :
Pada suhu dan tekanan yang sama semua gas yang volumenya sama mengandung jumlah molekul yang sama.
|
Misal :
a.Bila V liter gas hidrogen direaksikan dengan V liter gas klor dihasilkan 2V gas hidrogen klorida pada P dan T yang sama.(Hukum Gay Lussac)
maka,
b.1 molekul gas hidrogen direaksikan dengan 1 molekul gas klor dihasilkan 2 molekul gas hidrogen klorida pada P dan T yang sama.(Hukum Avogadro).
Berdasarkan hukum Gay Lussac-Avogadro persamaan reaksi di atas dapat ditulis :
H2(g) + Cl(g) 2 HCl(g)
Jika volume = V dan jumlah molekul = n dapat disimpulkan pada keadaan P dan T yang sama gas-gas yang mempunyai V sama akan mempunyai n yang sama.
Rumus :
Contoh soal:
Pada P dan T yang sama,2 liter gas NH3 mempunyai jumlah molekul sebanyak 5n molekul,maka dalam 10 liter gas SO3 terdapat berapa molekul ?
Jawab :
nSO3 = = 25n molekul